2-2) Diminution de la pression
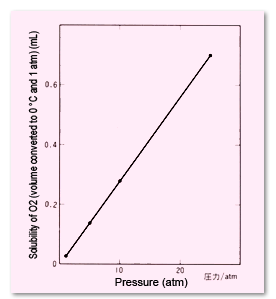
Fig. 3 Effets de la pression (pression partielle) sur la solubilité de l'O2 dans 1 mL d'eau (à 25 °C)
En général, plus la pression du gaz (pression partielle) est élevée, plus le gaz se dissout dans un liquide (Figure 3). Inversement, si un gaz à solubilité saturée est à haute pression, des bulles se formeront lorsque la pression sera réduite.
Remarque : 1 atmosphère (1 atm) = 1,013 × 105 Pa






