Caractérisation du site de liaison au glycane des glycopeptides liés à l'O à l'aide de la MS MALDI-TOF haute résolution MALDI-7090
La majorité des protéines synthétisées dans les organismes biologiques subissent une glycosylation. La glycosylation est une modification avec des glycanes de forte hétérogénéité structurelle composés de plusieurs monosaccharides, tels que le glucose et le galactose, liés entre eux. Ces glycanes sont classés en types liés à N et en types liés à O. Ces types de glycanes sont connus pour jouer un rôle important dans la régulation de la fonction des protéines, et l’obtention d’informations sur la glycosylation des protéines est essentielle au développement de produits biopharmaceutiques.
Une partie de ces informations liées à la glycosylation concerne l’endroit où le glycane est lié à la protéine. Presque tous les glycanes liés au N ont une séquence consensus d’acides aminés de -NXS/T-, qui est utilisée pour découvrir les sites potentiels de liaison des glycanes liés au N. Les sites de liaison des glycanes liés au N peuvent être déterminés en digérant une glycoprotéine avec une protéase, en collectant les glycopeptides du matériel digéré en utilisant la lectine qui se lie spécifiquement aux glycanes, en clivant les glycanes des peptides à l'aide de la N-glycosidase (PNGase F) en présence de H218O, en marquant les sites de liaison du glycane lié au N avec un isotope stable, puis en effectuant une analyse.1) Les sites de liaison du glycane lié au N peuvent également être déterminés par analyse MSn en utilisant des ions produits spécifiques aux glycopeptides liés au N.2) Le Un groupe de glycanes appelés glycanes liés à l'O sont connus pour se lier à un acide aminé sérine ou thréonine sur la protéine. Bien que peu d'informations soient souvent disponibles sur la séquence d'acides aminés autour de cette zone de liaison du glycane lié à l'O, il n'existe aucune enzyme adaptée pour cliver la liaison comme avec les glycanes liés à l'N, et aucun ion produit spécifique n'a encore été découvert, ce qui permet de déterminer du site de liaison des glycanes liés à l'O est difficile.
Dans cet article, nous présentons une méthode de détermination du site de liaison du glycane lié à l’O qui utilise une digestion partielle avec plusieurs enzymes.
Digestion partielle des glycanes avec des glycosidases
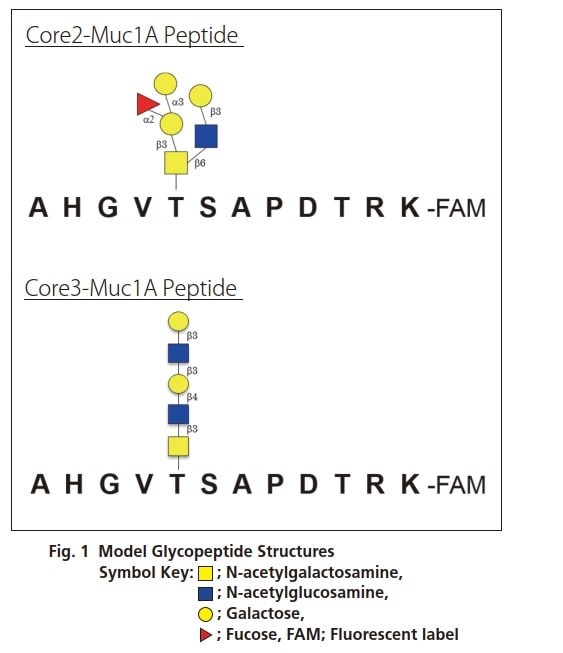
Les glycopeptides marqués au FAM liés à l'O présentés sur la figure 1 ont été utilisés comme glycopeptides modèles. Ce glycopeptide modèle (100 pmol) a été ajouté au cocktail d'enzymes ci-dessous dans une solution tampon et a réagi pendant 16 heures à 37 °C.

Le glycopeptide avant ajout au cocktail enzymatique et la solution obtenue après réaction avec le cocktail enzymatique ci-dessus ont été soumis à une analyse MS et MS/MS à l'aide du système MALDI-7090 après dessalement avec un ZipTip µC18.
MALDI-7090

Principales caractéristiques:
- Résolution MS/MS leader du marché
- Technologie laser UV à semi-conducteurs exclusive
- Vitesse d'acquisition ultra rapide en MS et MS/MS
- Chargeur 10 plaques intégré
- Logiciel MALDI Solutions™ nouvellement conçu


