Interfaces pour LCMS
La MS nécessite que les ions soient en phase gazeuse et ces ions sont détectés sous vide élevé dans la MS. Dans le cas de la GCMS, les composés cibles sont déjà séparés et élués à l'état gazeux. Dans ce cas, ils peuvent être directement introduits dans l'unité MS. Les composés gazeux sont ionisés par diverses méthodes telles que l'ionisation par impact électronique (EI) et l'ionisation chimique (CI).
Dans l'EI, les analytes gazeux traversent un rideau d'électrons à haute énergie où l'impact des électrons induit l'ionisation des composés. Cette ionisation à haute énergie fragmente les composés pour produire des ions de plus petit m/z. Cela est considéré comme une ionisation "dure" en raison du degré élevé de fragmentation. Plus l'énergie fournie est élevée, plus le degré de fragmentation est important. La Figure 6 montre la différence dans le spectre de masse de la riboflavine (vitamine B2) lorsqu'elle subit une EI par rapport à une ionisation "douce" comme l'ESI, où l'ion moléculaire et ses adducts sont couramment observés. Étant donné que l'énergie fournie par l'EI est uniforme (par exemple, 70 eV), le processus d'ionisation et de fragmentation par impact électronique est très reproductible, générant les mêmes espèces d'ions fragments à des rapports d'intensité prédéterminés. Pour cette raison, les spectres de masse produits par l'EI sont couramment utilisés pour identifier des échantillons et des pics inconnus en comparant les spectres acquis avec la bibliothèque de spectres contenue dans la base de données des composés.
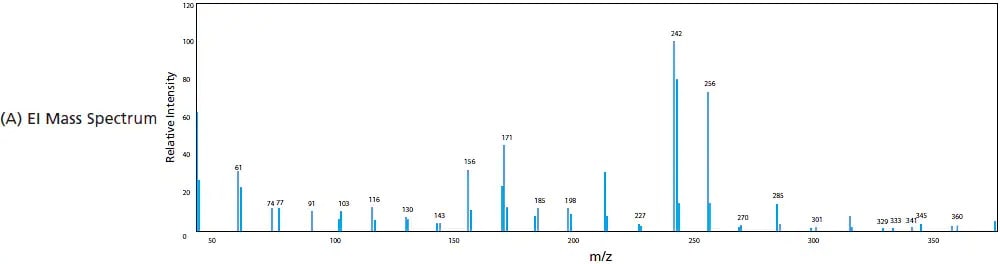
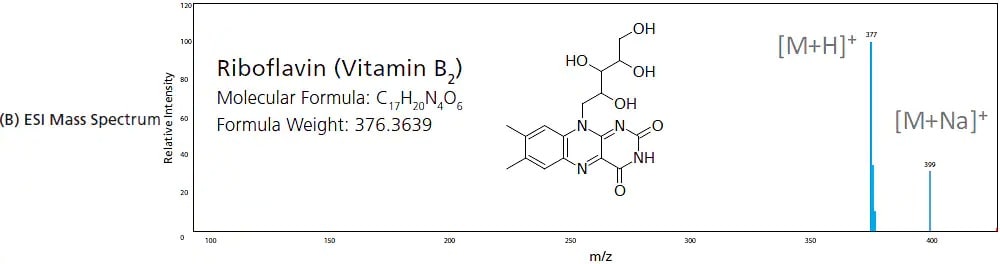
Figure 6. Spectres de masse produits par (A) EI (ionisation dure) et (B) ESI (ionisation douce).
Cependant, l'EI est considérée comme non applicable à la LCMS. Dans la chambre EI, les électrons à haute énergie utilisés pour l'ionisation sont produits en faisant passer un courant à travers un filament métallique sous vide élevé. Avec la LCMS, le flux LC est incompatible avec le système à vide élevé requis pour l'EI et le chauffage du filament métallique dans des conditions atmosphériques provoque sa combustion et son évaporation (par exemple, l'oxydation du filament de tungstène à haute température). En conséquence, l'utilisation de l'EI dans la LCMS n'est pas adaptée en raison des conditions très différentes dans lesquelles elles fonctionnent chacune, ce qui crée finalement des difficultés mécaniques et des problèmes d'interface. Par conséquent, il est crucial d'avoir une interface pour connecter la sortie LC à l'entrée MS qui puisse transférer efficacement la phase mobile LC en gaz et en même temps ioniser les analytes.
Diverses interfaces pour LCMS ont été développées, mais des problèmes de sensibilité, de stabilité et de convivialité ont été rencontrés. Après d'autres améliorations et développements, l'API, un type de technique d'ionisation douce, s'est avérée bien adaptée à l'utilisation dans la LCMS. Comme son nom l'indique, elle ionise les composés dans des conditions de pression atmosphérique, ce qui la rend particulièrement utile pour éliminer les solvants en dehors d'un vide. L'API sert à la fois de source d'ionisation et d'interface dans un système LCMS. En général, les ions générés par l'API sont dépouillés de leur solvant, focalisés en un faisceau à l'aide d'un guide d'ions, et finalement introduits dans l'analyseur de masse. Trois techniques API sont décrites ici, à savoir l'ionisation par électrospray (ESI), l'ionisation chimique à pression atmosphérique (APCI) et la photoionisation à pression atmosphérique (APPI).
Ionisation par électrospray (ESI)
L'ESI génère des ions en aspirant et en pulvérisant d'abord des solutions d'échantillons à l'extrémité d'un tube capillaire, où une haute tension d'environ ± 3 à 5 kV est appliquée. Cela génère une fine brume de gouttelettes chargées avec la même polarité que la tension appliquée. Pour accommoder un débit LC plus important, le nébuliseur et les gaz de chauffage s'écoulent de l'extérieur du capillaire pour accélérer le processus d'évaporation du solvant. À mesure que ce processus se poursuit, le champ électrique à la surface de la gouttelette augmente. Lorsque la force de répulsion mutuelle des charges dépasse la tension superficielle du liquide (c'est-à-dire la répulsion), une fission se produit. On pense que, à mesure que ce cycle d'évaporation et de fission se répète, les gouttelettes deviennent finalement suffisamment petites pour que les ions de l'échantillon soient libérés dans la phase gazeuse (basé sur le modèle d'évaporation des ions). Une représentation schématique des processus de génération et de désolvation dans l'ESI pour les ions chargés positivement est illustrée à la Figure 7. De même, les ions chargés négativement sont générés en appliquant une tension négative sur la sonde ESI.
L'ESI est l'une des méthodes d'ionisation les plus douces disponibles, ce qui signifie que la fragmentation est minimale et qu'elle peut être utilisée pour des composés très polaires, peu volatils ou thermiquement instables. Étant donné que la plupart des composés résultent en ions moléculaires protonés (ou déprotonés) et en ions adducts, sans générer d'ions fragments compliqués, la détermination de la masse moléculaire des composés est très simple.
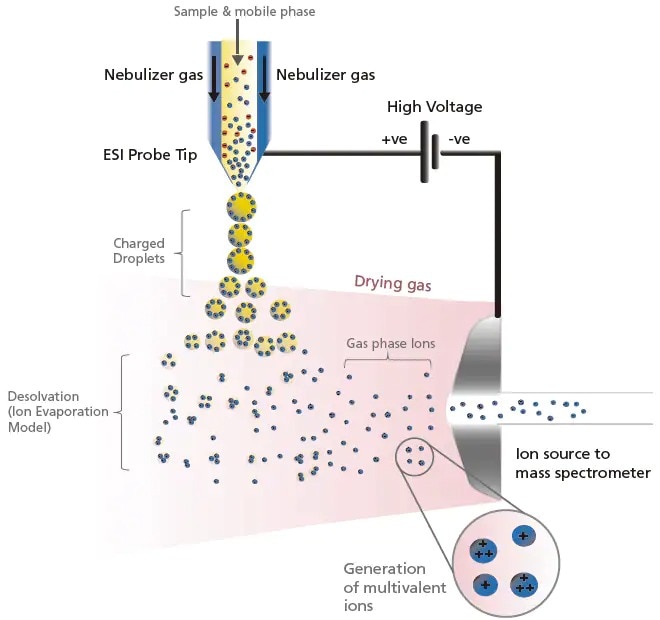
Figure 7. Schéma des processus d'ionisation et de désolvation en mode ESI positif (+).
De plus, l'ESI est connue pour générer occasionnellement des ions moléculaires avec des charges multiples pour les composés ayant plusieurs groupes fonctionnels susceptibles d'accepter des charges. Dans le cas des cations, cela signifie que plusieurs protons sont ajoutés pour former [M + nH]n+. La tendance à former des ions multivalents est fortement influencée par le pKa du composé par rapport au pH de la solution. Lorsque l'ion multivalent est observé, des informations sur la masse moléculaire peuvent être obtenues même pour des composés ayant une masse moléculaire qui dépasse la plage de mesure du spectromètre de masse. Il est également possible d'utiliser le traitement informatique pour prédire la masse moléculaire à partir de ces ions multivalents. Un exemple de myoglobine est illustré à la Figure 8. Pour la myoglobine, des ions avec des valences (n) de 10 à 20 ont été détectés et la masse moléculaire a été calculée par déconvolution pour être de 16951,3. Cette particularité de l'ESI-LCMS permet l'analyse et la mesure de macromolécules biologiques extrêmement grandes et très polaires, telles que les protéines et les acides nucléiques. Cela est très différent de la GCMS, qui ne fournit généralement que des pics de z = 1.
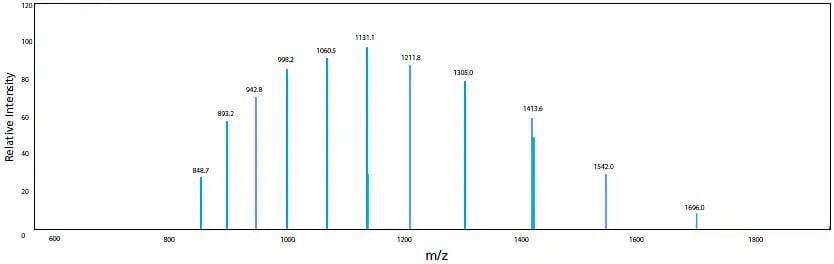
Figure 8. Masse moléculaire de la myoglobine calculée à l'aide du spectre ESI et de la déconvolution, des ions multivalents (n = 10 à 20) de la myoglobine sont observés dans le spectre de masse ESI.
Ionisation chimique à pression atmosphérique (APCI)
L'autre technique API est l'APCI, qui est un type d'ionisation chimique. Bien que la conception de l'interface soit similaire à celle de l'ESI, le principe d'ionisation diffère, ce qui la rend plus adaptée aux composés de faible et moyenne polarité (molécules non polaires). Comme illustré à la Figure 9, l'APCI vaporise les molécules de solvant et d'échantillon en pulvérisant la solution d'échantillon dans un chauffage (environ 400 °C) à l'aide d'un gaz, tel que le N2. Les molécules de solvant sont ionisées par l'aiguille de décharge corona pour générer des ions de réaction stables. Les protons sont transférés entre ces ions de réaction stables et les molécules d'échantillon (réaction ion-molécule), ce qui conduit à l'ionisation. Il est connu que ces réactions ion-molécule impliquent plusieurs schémas, tels que les réactions de transfert de protons et les réactions d'addition électrophile. Contrairement à l'ESI, l'APCI implique un processus à énergie plus élevée et n'a pas tendance à former des ions multichargés [M + nH]n+. Par conséquent, elle est couramment utilisée pour analyser des composés hautement liposolubles ou des composés qui ne s'ionisent pas en solution.
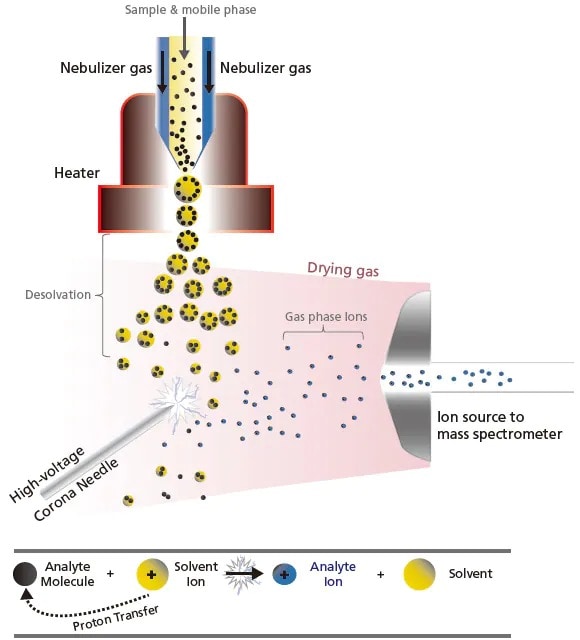
Figure 9. Schéma de la réaction ion-molécule (par exemple, transfert de protons) dans l'APCI.
Photoionisation à pression atmosphérique (APPI)
L'APPI ionise les analytes par irradiation de lumière ultraviolette sous vide (VUV) à courte longueur d'onde. La conception de l'interface dans l'APPI (Figure 10) est très similaire à celle de l'APCI, avec seulement le remplacement de l'aiguille de décharge corona haute tension par la lampe VUV. De même, le nébuliseur et le chauffage sont utilisés pour créer des gouttelettes et vaporiser le solvant. Lors de l'irradiation par la lumière VUV, les analytes absorbent un photon et sont excités électroniquement. Si l'énergie d'ionisation de l'analyte est inférieure à l'énergie du photon, l'ion analyte qui a été ionisé par les photons peut recevoir un proton de l'hydrogène dans le solvant pour devenir un cation protoné. Cette technique d'ionisation permet une ionisation de bonne sensibilité avec des composés de polarité faible à modérée (par exemple, les aromatiques polycycliques).
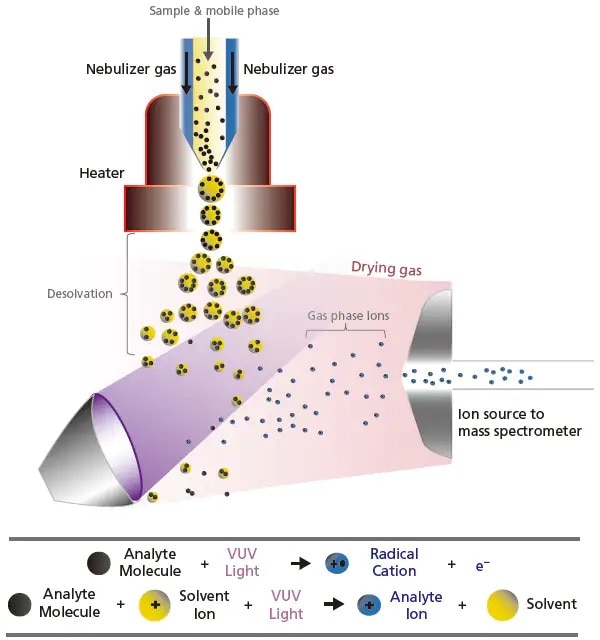
Figure 10. Schéma du processus d'ionisation par la lumière UV dans la photoionisation à pression atmosphérique (APPI).
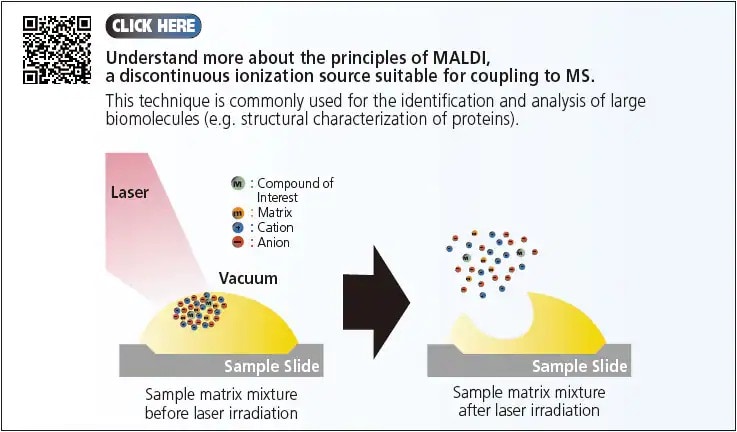
En résumé, les ions peuvent être générés soit en mode continu, soit en mode pulsé (discontinu). Les trois techniques API (ESI, APCI et APPI) qui ont été présentées fonctionnent en mode continu, fournissant un flux constant d'ions à la MS. D'autre part, le mode pulsé génère une source discontinue d'ions telle que la désorption/ionisation laser assistée par matrice (MALDI). Dans cette section, nous avons présenté les composants de la LCMS et discuté des principes des différentes options API pour l'interface LCMS. Ensuite, nous avons examiné l'efficacité de ces processus d'ionisation et l'importance de sélectionner des conditions analytiques appropriées pour la LCMS.
Aperçu de l'ionisation à pression atmosphérique (API)
Plusieurs paramètres affectent l'efficacité et la sensibilité de ces processus API (c'est-à-dire ESI, APCI et APPI). Outre les spécifications et paramètres de l'instrument, les facteurs limitants sont :
- Débit de la LC ou entrée de liquide
- Solvants / phases mobiles (par exemple, types, pH et additifs utilisés)
- Propriétés des analytes (par exemple, volatilité, stabilité thermique et capacité à former des espèces chargées)
- Effets de matrice (par exemple, suppression et amélioration)
- Sortie de la LC (par exemple, largeur de pic)
Le débit est l'un des paramètres clés pour obtenir une haute sensibilité, en particulier pour l'ESI. En LCMS, une colonne LC semi-micro (2 mm de diamètre interne (ID)) est préférée à la colonne LC conventionnelle (4,6 mm ID) couramment utilisée en HPLC. En utilisant une colonne de diamètre interne plus petit, le débit optimal pour la séparation chromatographique est plus faible, et un débit plus faible augmente généralement l'efficacité de l'ionisation de l'ESI. Pour cette raison, une unité d'ionisation ESI standard est conçue pour atteindre une sensibilité optimale pour un débit de 0,2-0,8 mL/min et la sensibilité est généralement compromise à des débits plus élevés.
Ensuite, les modifications apportées aux phases mobiles telles que les types et le pH des phases mobiles et l'utilisation d'additifs peuvent particulièrement affecter la sensibilité de ces API. En particulier pour l'ESI, la formation de gouttelettes et d'ions est cruciale pour obtenir une haute sensibilité. Il est important d'obtenir des gouttelettes extrêmement fines et de libérer des ions de ces gouttelettes en réduisant la tension superficielle des gouttelettes et en optimisant le pH des gouttelettes. Par exemple, dans l'Équation 1, un composé basique (R-NH2) est couramment détecté sous forme d'ions positifs [RNH3]+. En ajoutant un réactif acide (AH), cela déplace l'équilibre vers la droite, ce qui augmente la production des ions positifs et donc la sensibilité. En général, une phase mobile souhaitée a une valeur de pH inférieure de 1 ou 2 à la valeur de pKa de l'échantillon. Inversement, pour les composés acides (Équation 2), la sensibilité peut être augmentée en ajoutant un réactif basique (B) ou en utilisant une phase mobile avec un pH supérieur à celui du pKa de l'échantillon. Dans le cas des composés neutres sans groupe fonctionnel ionique, l'ajout d'un sel volatil tel que l'acétate d'ammonium peut parfois augmenter l'efficacité de l'ionisation en tant qu'ions adducts.
Équation 1 :
R-NH2 + AH → [R-NH3]+ + A-
Équation 2 :
R-COOH + B → [R-COO]- + BH+
De plus, il peut être efficace d'augmenter la proportion de solvant organique pour réduire la tension superficielle et accélérer l'évaporation du solvant. Si l'utilisation de ces additifs affecte la séparation LC, la solution peut également être ajoutée après la séparation (avant l'analyse MS).
Dans le cas de l'APCI, il nécessite que les analytes soient thermiquement stables et volatils. Il est idéal pour l'ionisation de composés de faible à moyenne masse moléculaire (par exemple, hydrocarbures polyaromatiques, glucides et triglycérides) mais ne convient pas aux macromolécules en raison de leur point d'ébullition élevé. L'efficacité de l'ionisation de l'APCI est plus gouvernée par la propriété chimique du solvant que par celle de l'analyte. L'APCI nécessite que le solvant soit protique, c'est-à-dire qu'il ait une affinité protonique suffisamment élevée pour afficher des liaisons hydrogène, afin de faciliter l'ionisation de l'analyte. Si l'utilisation d'un solvant protique ne convient pas à la séparation chromatographique, d'autres solvants non protiques peuvent être utilisés avec quelques pourcentages de solvant protique ajoutés pour aider à l'ionisation. En général, l'APCI peut être utilisé en modes phase inverse, phase normale et exclusion de taille et est moins affecté par les sels par rapport à l'ESI.
Pour l'APPI (Figure 11), la sensibilité peut parfois être augmentée en ajoutant un composé (dopant), qui a une énergie d'ionisation inférieure à celle des analytes. Le dopant facilite et augmente l'ionisation des analytes, augmentant ainsi la sensibilité.
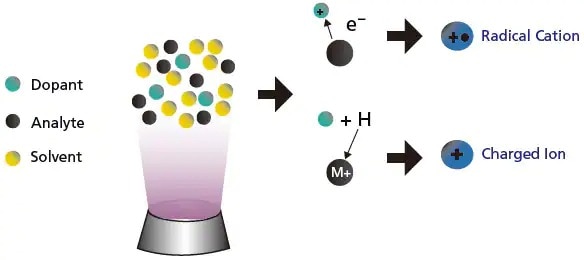
Figure 11. Illustration de l'utilisation d'un dopant pour augmenter la sensibilité dans l'APPI.
En général, la sélection des techniques API en LCMS est basée sur les polarités et les propriétés des analytes. Le Tableau 2 résume les propriétés des analytes requises pour les trois techniques API. Ces techniques API peuvent être encore optimisées en faisant varier les phases mobiles et le débit pour réduire les effets de matrice et améliorer l'efficacité et la sensibilité. Comme décrit (Figure 4), l'ESI est généralement sélectionnée pour les composés à haute polarité que l'on trouve généralement dans les médicaments et les pesticides, tandis que l'APCI et l'APPI sont généralement sélectionnés pour les composés ayant une polarité plus faible, tels que les aromatiques polycycliques et les mycotoxines.
| Techniques API | ESI | APCI | APPI |
|---|---|---|---|
| Processus d'ionisation | Les ions en solution passent en phase gazeuse par électrospray | L'ionisation se produit en phase gazeuse par décharge corona | L'ionisation se produit en phase gazeuse par irradiation UV |
| Types d'ions formés | Ions monovalents Ions multivalents | Ions monovalents | Ions monovalents |
| Volatilité de l'analyte | Pas besoin d'être volatil | Requiert un certain degré de volatilité | Requiert un certain degré de volatilité |
| Stabilité de l'analyte | Pas besoin d'être thermiquement stable. Peut être thermolabiles. | Doit être thermiquement stable | Doit être thermiquement stable |
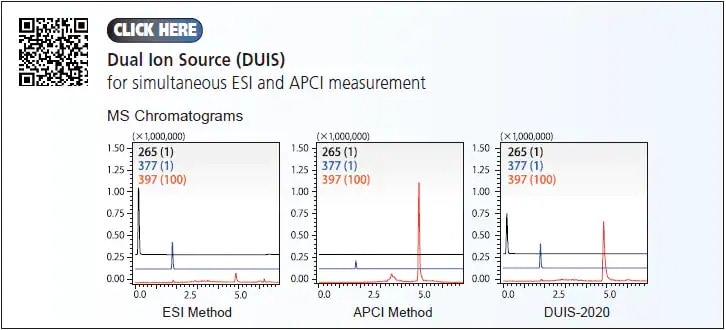
Dans le cas où l'analyse de plusieurs composants aux polarités et propriétés différentes est requise, certains échantillons peuvent devoir être analysés par plusieurs réglages pour couvrir toute la gamme des composés. Pour raccourcir le temps total requis pour l'analyse et le développement de méthodes, et pour améliorer à la fois l'efficacité du laboratoire et la confiance dans les résultats, Shimadzu a développé la source d'ions double (DUIS) qui permet une ESI et une APCI simultanées. Avec cette technologie, il est possible d'obtenir un débit d'échantillons plus élevé où les deux ionisations (c'est-à-dire ESI et APCI) peuvent être réalisées en une seule fois.