LC & LC-MS conformes à la réglementation sur le diagnostic in vitro (IVDR)
Shimadzu propose des dispositifs médicaux de chromatographie liquide et de spectrométrie de masse.

Qu’est-ce que le nouveau règlement européen sur le diagnostic in vitro (IVDR) ?
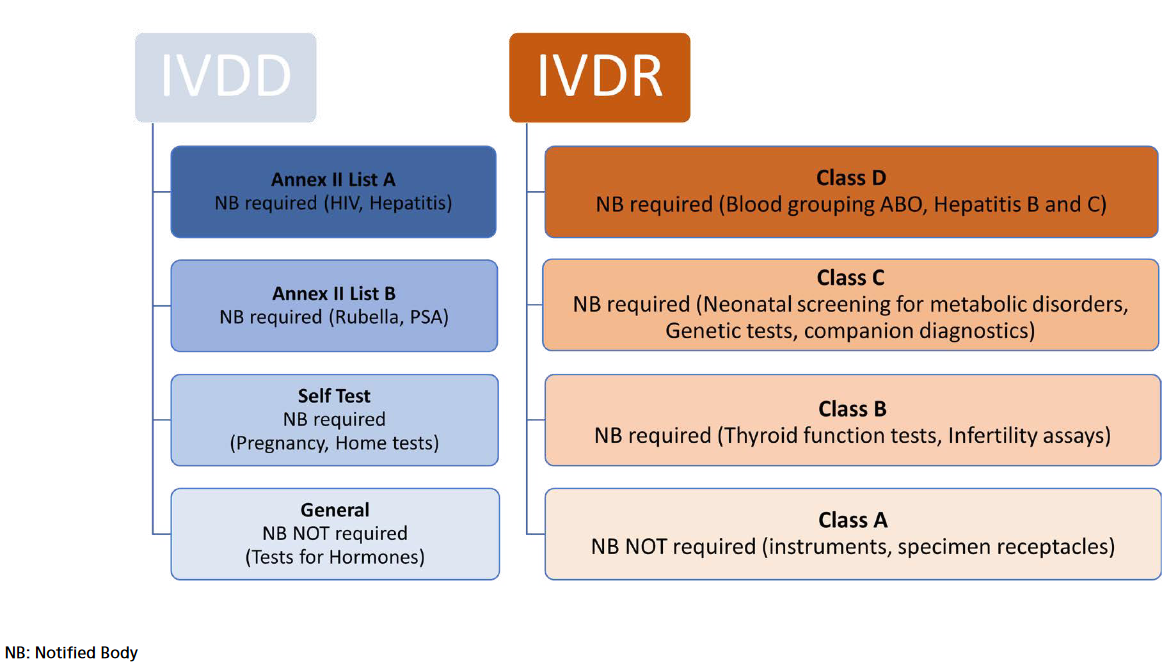
Figure 1. Classification basée sur le risque IVDR
Le nouveau règlement sur les dispositifs médicaux de diagnostic in vitro (IVDR) (UE) 2017/746 a été publié au Journal officiel de l'UE en mai 2017 afin de garantir un niveau élevé de sécurité et de santé tout en soutenant l'innovation. Elle s'applique à partir du 26 mai 2022 et remplace la précédente directive DIV (98/79/CE). Ce règlement fixe des règles pour les dispositifs de diagnostic in vitro tels que les réactifs, les calibrateurs, les kits, les instruments et les logiciels destinés par le fabricant à être utilisés à des fins de diagnostic. L'IVDR conserve certains concepts de la directive IVD tels que le marquage CE ou les exigences essentielles (sous l'IVDR appelées «
exigences générales de sécurité et de performance »). Comme par le passé, les fabricants doivent démontrer qu'eux-mêmes et leurs appareils satisfont aux exigences par le biais d'une procédure d'évaluation de la conformité. Cependant, à la différence de la directive IVD, l'IVDR a introduit la classification basée sur le risque (Figure 1). Les appareils IVDR sont classés en quatre : les appareils présentant les risques les plus élevés sont classés dans la classe D. Les appareils de la classe A présentent de faibles risques et comprennent des produits destinés à un usage général en laboratoire, des accessoires qui ne possèdent aucune caractéristique critique.
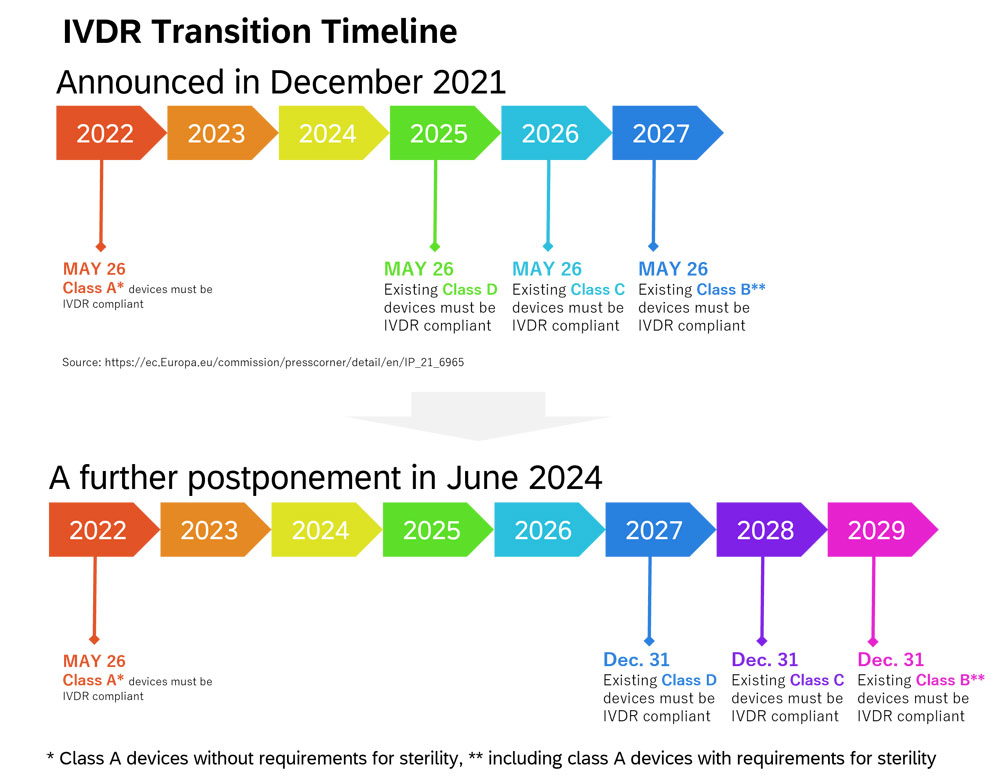
Figure 2. IVDR Transition Timeline
Comme le montre la figure 2, une auto-déclaration de conformité du fabricant qui répond aux exigences de l'IVDR est nécessaire pour placer les appareils de classe A* sur le marché de l'UE à partir du 26 mai 2022. Les appareils de classe B**, C et D nécessitent la certification. de l'organisme notifié (ON) accrédité pour être mis sur le marché de l'UE. Alors que seulement 8 % des appareils nécessitaient une certification NB en vertu de la directive IVD, 78 % des appareils nécessitent une certification NB en vertu de l'IVDR. 1 Malgré le fait, le nombre d'ON accrédités dans l’UE est faible. 2 C'est pourquoi, en décembre 2021, la période de transition a été décalée selon les classes (classe B** jusqu'au 26 mai 2027, classe C jusqu'au 26 mai 2026 et classe D jusqu'au 26 mai 2025). La Commission européenne a publié un nouvel amendement en juin 20243, et la période de transition des dispositifs de classe B** sera reportée au 31 décembre 2029, celle de la classe C au 31 décembre 2028 et celle de la classe D au 31 décembre 2027.
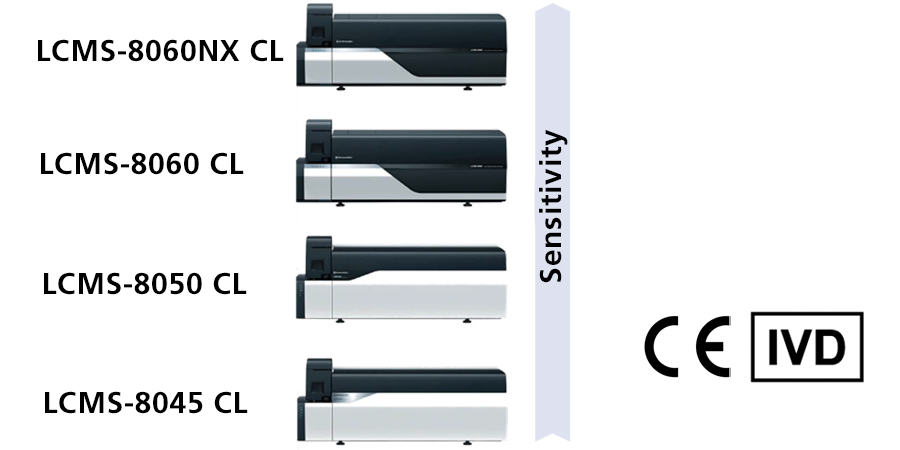
CL Series de Shimadzu
Si une HPLC ou LC-MS/MS pour la recherche uniquement (RUO) est utilisée à des fins de diagnostic, elle peut être convertie en appareil interne conformément à l'article 5, paragraphe 5, de l'IVDR. Toutefois, le travail requis pour satisfaire aux exigences de l'article 5, paragraphe 5, est énorme. Par conséquent, nous recommandons l’introduction de produits IVDR de classe A pour l'HPLC et le LC-MS/MS afin de réduire la charge de travail. Shimadzu a déjà lancé des appareils IVDR classe A pour HPLC (LC-40 CL) et LC-MS/MS (LCMS-8045/8050/8060/8060NX CL) en 2022. La HPLC IVDR classe A est disponible sans MS. Chaque unité (pompe, échantillonneur automatique, four, vanne et détecteur (UV)) est IVDR classe A, la combinaison peut donc être personnalisée. Pour le LC-MS/MS, les séries peuvent être sélectionnées en fonction de la sensibilité requise.
Shimadzu a également lancé un dispositif IVDR de classe A, le CLAM-2040 CL, un module de préparation d'échantillons entièrement automatisé pour le LC-MS/MS de Shimadzu, qui permet un flux de travail continu, du prétraitement laborieux au LC-MS/MS entièrement automatisé. Le CLAM-2040 CL n'est pas seulement transparent, il est aussi flexible. En fonction de l'application, vous pouvez choisir un LC-MS/MS conforme à l'IVDR de classe A à combiner avec le CLAM-2040 CL. La conception permet également la connexion au LIS (Laboratory Information System) et au LAS (Laboratory Automation System), ce qui permet de réaliser une large gamme de tests et d'améliorer le flux de travail à l'aide du LC-MS/MS. Ce dispositif IVD, en combinaison avec un kit de IVD disponible dans le commerce, devrait soulager l'utilisateur de l'énorme quantité de travail nécessaire pour répondre aux exigences de l'article 5(5) de l'IVDR. Seule la validation par combinaison est encore requise.
Appareils homologués pour chromatographe liquide et spectrométrie de masse série CL (pour CE-IVD UE) :
|
|---|
NB : Ces instruments ne sont disponibles que sur le marché cible où la procédure d'évaluation de la conformité du produit (CE IVDR) est acceptée.
Ces instruments sont conçus/développés, fabriqués, installés et réparés dans le cadre d'un système de gestion de la qualité certifié selon la norme EN ISO 13485:2016 pour les dispositifs médicaux et les services associés.
Références
- Rapport d'enquête MedTech Europe, 8 septembre 2021.p.6-7.
rapport d'enquête medtech-europe-analysant-la-disponibilité-des-dispositifs-médicaux-de-diagnostic-in-vitro-div-en-mai-2022-lorsque-le-nouveau-règlement-ue-ivd-s'applique-8- septembre-2021.pdf (medtecheurope.org) - Au 2 mai 2025, il n'existe plus que 17 organismes notifiés.
EUROPA – Commission européenne – Croissance – Politique réglementaire - SMCS - Publications Office (europa.eu)
Regulation (EU) 2024/1860 of the European Parliament and of the Council of 13 June 2024 amending Regulations (EU) 2017/745 and (EU) 2017/746 as regards a gradual roll-out of Eudamed, the obligation to inform in case of interruption or discontinuation of supply, and transitional provisions for certain in vitro diagnostic medical devicesText with EEA relevance. (europa.eu) - MDCG 2023-1 Orientations sur l'exemption des établissements de santé en vertu de l'article 5, paragraphe 5, du règlement (UE) 2017/745 et du règlement (UE) 2017/746, janvier 2023, p.3.
mdcg_2023-1_en.pdf (europa.eu) - mdcg_2023-1_en.pdf (europa.eu)
- HYPERLIEN EUR-Lex - 52024PC0043 - FR - EUR-Lex (europa.eu)
- Règlement MDCG 2022-8 (UE) 2017/746 – application des exigences IVDR aux « dispositifs existants » et aux dispositifs mis sur le marché avant le 26 mai 2022 conformément à la directive 98/79/CE
sur les anciens dispositifs DIV (europa.eu) .