Analyse des modifications post-traductionnelles | Analyse de phosphorylation par MALDI-TOF MS (1)
Analyse des modifications post-traductionnelles
Analyse de phosphorylation par MALDI-TOF MS (1)
■ Sélection du mode de mesure et de la matrice idéales pour la détection des phosphopeptides
La phosphorylation est un type de modification post-traductionnelle des protéines. Il joue un rôle important dans les organismes.
L'analyse des phosphopeptides par détection MALDI est présentée ci-dessous.
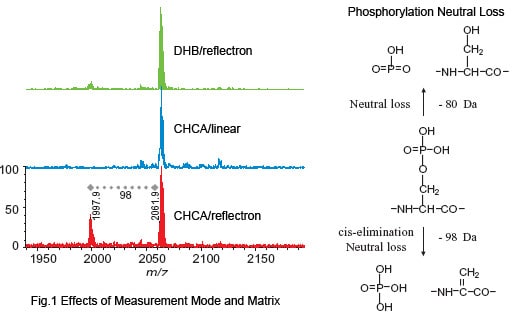
Pour obtenir une résolution et une précision plus élevées, le mode réflectron est utilisé pour les mesures normales de peptides. Cependant, dans ce mode, les signaux provenant des phosphopeptides cibles sont difficiles à détecter en raison du phénomène dit de perte neutre, par lequel le groupe phosphate est dissocié du phosphopeptide. Par conséquent, ces composés instables sont d’abord mesurés en mode linéaire.
Comme le montre la figure 1, seul le signal correspondant au phosphopeptide est observé en mode linéaire. En utilisant DHB comme matrice, un spectre peut également être obtenu en mode réflectron avec la perte neutre comparativement supprimée.
A l’inverse, la perte neutre peut également être utilisée pour évaluer l’absence ou la présence de phosphorylation. Si une perte neutre est découverte lors des comparaisons entre le mode réflectron et le mode linéaire et entre DHB et CHCA, il existe une forte probabilité que le peptide soit phosphorylé.
Un autre problème lié à l’analyse des phosphopeptides est la diminution significative de la sensibilité de détection des peptides due à la modification de la phosphorylation. Par conséquent, il est souvent difficile d’observer les phosphopeptides dans les digestions enzymatiques protéiques.
Les méthodes permettant de résoudre ce problème comprennent l'ajout d'acide phosphorique à la matrice et l'augmentation de la concentration d'acide trifluoroacétique (TFA) pour maintenir l'acidité.
La figure 2 montre l'effet de l'ajout d'acide phosphorique lors de l'utilisation du DHB comme matrice. Un mélange de quatre protéines digérées a été analysé en mode réflectron.
Lorsqu'ils sont mesurés en utilisant uniquement le DHB, les phosphopeptides contenus en grandes quantités peuvent être observés, mais les phosphopeptides contenus en petites quantités sont presque impossibles à observer. Cependant, le phosphopeptide proche de m/z 3000 a pu être observé lorsque de l'acide phosphorique était ajouté à la matrice.
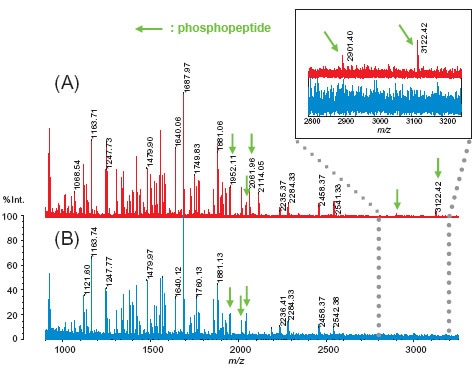
Fig. 2 Ajout d'acide phosphorique : (A) Acide phosphorique ajouté (0,5 %), (B) Aucun acide phosphorique ajouté
Par conséquent, la modification du mode de mesure ou de la composition de la matrice améliore la sensibilité de détection des phosphopeptides dans le mélange d’échantillons. Ces étapes de base sont utilisées pour l'analyse structurelle telle que MS/MS.
AXIMA Performance MALDI-TOF MS

L'AXIMA Performance est l'un des outils les plus puissants en spectrométrie de masse, fournissant des spectres riches en informations avec une plus grande sensibilité et une plus grande confiance dans l'identification . Il s'agit d'un système TOF-TOF extrêmement polyvalent et puissant, intégrant des flux de travail pour un large éventail de besoins analytiques.
- De la MS/MS à haute énergie de la protéomique et d'autres échantillons biologiques et organiques à l'analyse sans compromis de protéines intactes de masse élevée
- Véritable MS/MS - CID à haute énergie avec une énergie de collision de cadre en laboratoire de 20 keV
- Résolution optimale de sélection des ions précurseurs grâce à une technologie de déclenchement révolutionnaire
- Sensibilité exceptionnelle - conception sans compromis, pour garantir qu'aucun signal MS/MS n'est rejeté


