Analyse des glycopeptides d'anticorps monoclonaux à l'aide de MALDI-TOF MS haute résolution MALDI-7090
Les anticorps utilisés dans les produits biopharmaceutiques sont souvent soumis à une modification des glycanes. Ce glycane est une molécule à forte hétérogénéité structurelle constituée de monosaccharides étroitement couplés, tels que le glucose et le mannose, et cette structure complexe est connue pour jouer un rôle important dans la régulation fonctionnelle des protéines. Cependant, les informations telles que la structure complexe du glycane et le site où le glycane est attaché à la protéine ne sont pas écrites au préalable dans le gène. Il s’agit plutôt d’informations formées sur la base des actions de nombreuses glycosyltransférases au cours du processus de biosynthèse des protéines. Ainsi, selon l'état de croissance des cellules qui produisent les anticorps, il n'est pas rare d'observer des phénomènes tels que la formation de glycanes ayant des structures différentes malgré le même squelette protéique, ou la formation de la liaison glycane à un endroit inattendu. . Par conséquent, lorsqu’un anticorps est biosynthétisé en tant que produit biopharmaceutique, l’élucidation de sa structure et de son site de liaison est importante. Les spectromètres de masse sont désormais régulièrement utilisés pour déterminer à la fois le site de liaison et la structure des glycanes.
Ici, en utilisant le MALDI-TOF MS haute résolution MALDI-7090 avec sa capacité unique de fragmentation à haute énergie de 20 keV, nous introduisons un exemple d'analyse pour déterminer la structure et le site de liaison d'un glycane lié à un anticorps.
Préparation de glycopeptides à partir d'une glycoprotéine
Tout d’abord, en utilisant un anticorps monoclonal disponible dans le commerce comme échantillon, la réduction et l’alkylation ont été réalisées dans la solution. Ensuite, de la trypsine a été ajoutée à cette solution, permettant ainsi à la digestion enzymatique de se poursuivre pendant 2 heures. La solution digérée par l'enzyme a ensuite été ajoutée à une colonne de centrifugation remplie de gel Sepharose CL4B préalablement équilibré avec du butanol: éthanol: eau (4: 1: 1), et la solution a pu interagir avec le gel, permettant l'adsorption du glycopeptide. le gel. Ensuite, par lavage avec la solution équilibrée pour éliminer les peptides non glycosylés, les glycopeptides ont été récupérés en utilisant une solution aqueuse d'éthanol. Les glycopeptides récupérés ont été déposés sur une plaque cible en utilisant l'acide 2,5-dihydroxybenzoïque (DHB) comme matrice et analysés à l'aide du MALDI-7090.
Analyse MS de la fraction glycopeptide
Le spectre de masse de la fraction glycopeptidique récupérée est présenté sur la figure 1. Parmi les signaux détectés, m/z 2405,72, 2430,75, 2567,72, 2592,73, 2633,74, 2795,74 et 2957,74 ont été considérés comme des signaux dérivés de glycopeptides. Étant donné que les glycanes ont une structure non uniforme, plusieurs structures de glycanes différentes sont présentes dans un seul squelette peptidique. Puisqu’un signal dans MADLI-TOF MS est associé à un ion monovalent, il est possible d’observer les différences de masse entre les pics, et s’ils correspondent à la masse d’un fragment glycane, alors ces pics sont probablement des glycopeptides.
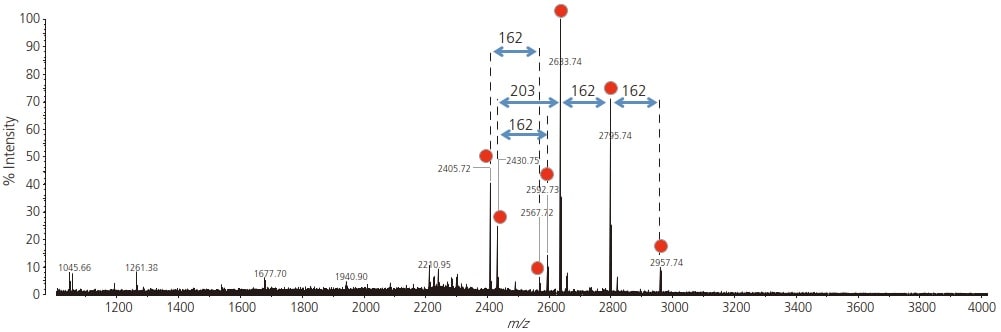
Fig. 1 Spectre de masse de la fraction glycopeptide à partir des signaux glycopeptides IgG monoclonaux sont représentés par des cercles rouges.


