Analyse de la séquence d'acides aminés N-terminaux de l'anticorps monoclonal à l'aide du MALDI-TOF MS haute résolution MALDI-7090
Dans le développement biopharmaceutique d'un anticorps, il est connu qu'une hétérogénéité peut parfois se produire au niveau de l'extrémité N-terminale ou C-terminale d'une protéine. Par exemple, il existe des cas où l’acide aminé terminal a été éliminé ou modifié. Il est donc très important de comprendre un tel changement de structure pour maintenir la qualité des produits biopharmaceutiques. Généralement, lors de la détermination de la séquence d'acides aminés d'une protéine, un séquenceur de protéines qui utilise la méthode fiable de dégradation d'Edman est utilisé pour déterminer les acides aminés N-terminaux un par un.
Si le groupe amino N-terminal (groupe α-amino) a été modifié, la méthode de déblocage est généralement utilisée pour permettre l’utilisation du séquenceur protéique. Mais parfois ce déblocage n'aboutit pas en raison de l'existence de plusieurs types de modifications et de la difficulté d'optimiser les conditions réactionnelles.
Par conséquent, l’analyse de séquence par spectrométrie de masse est parfois nécessaire comme alternative. Étant donné que certains acides aminés ont une masse similaire, voire exactement la même, un spectromètre de masse capable d'effectuer une MS/MS à très haute résolution est nécessaire.
Ici, nous introduisons un exemple d’analyse de séquence d’acides aminés N-terminaux de molécules d’anticorps à l’aide du Shimadzu MALDI-7090 MALDI-TOF MS haute résolution.
Préparation du peptide N-terminal à partir de Protein Digest
L'anticorps monoclonal sélectionné comme échantillon analytique a d'abord été soumis à une SDS-PAGE pour séparer l'anticorps en chaînes lourdes et en chaînes légères. La préparation du peptide N-terminal a été réalisée selon la méthode décrite par Yamaguchi et al.1) Le protocole est le suivant : Les morceaux de gel respectifs des chaînes lourdes et des chaînes légères ont été soumis à une réduction et à une alkylation, le résidu lysine a été soumis à une guanidination. , et la dérivatisation du groupe amino N-terminal a été réalisée à l'aide de sulfo-n-hydroxysuccinimidobiotine. Après cela, la digestion dans le gel a été réalisée à l'aide de trypsine, les fragments de digestion ont été soumis à une oxydation à l'acide performique et de la résine DITC a été ajoutée au fragment clivé de la liaison SS dérivée N-terminale. Ainsi, les fragments digérés (fragments de séquence interne de protéine) avec un groupe α-amino exposé sont adsorbés sur la résine DITC tandis que les peptides N-terminaux dérivés de l'acide sulfonique obtenus par le procédé décrit ci-dessus et les peptides N-terminaux avec des extrémités bloquées sont autorisés. rester en solution. Cette solution a été collectée et soumise à une analyse MS/MS à l’aide du MALDI-7090.
Analyse MS de la fraction peptidique N-terminale
Lorsque les chaînes lourdes et légères d'anticorps respectives ont été soumises à une analyse MS, les peptides N-terminaux ont été détectés à m/z 2044,10 et 1850,09 respectivement (Fig. 1).
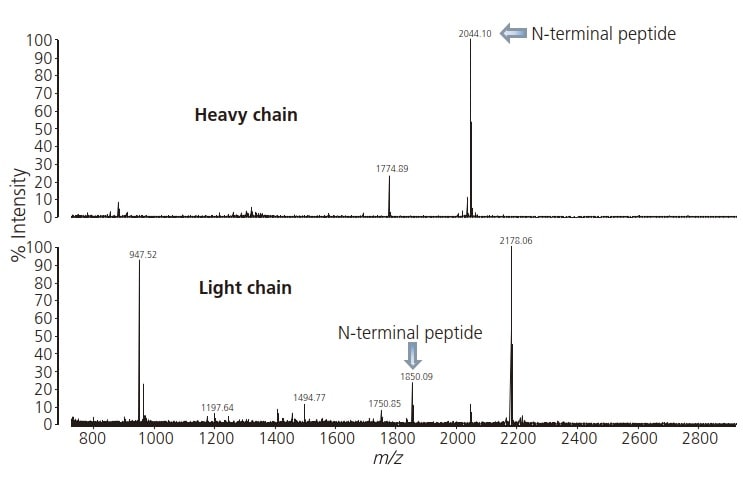
Fig. 1 Spectres de masse des peptides de la fraction N-terminale extraits des IgG monoclonaux
[Référence] 1) M. Yamaguchi et.al. Commune rapide. Spectromètre de masse., 22 3313-3319 (2008)



