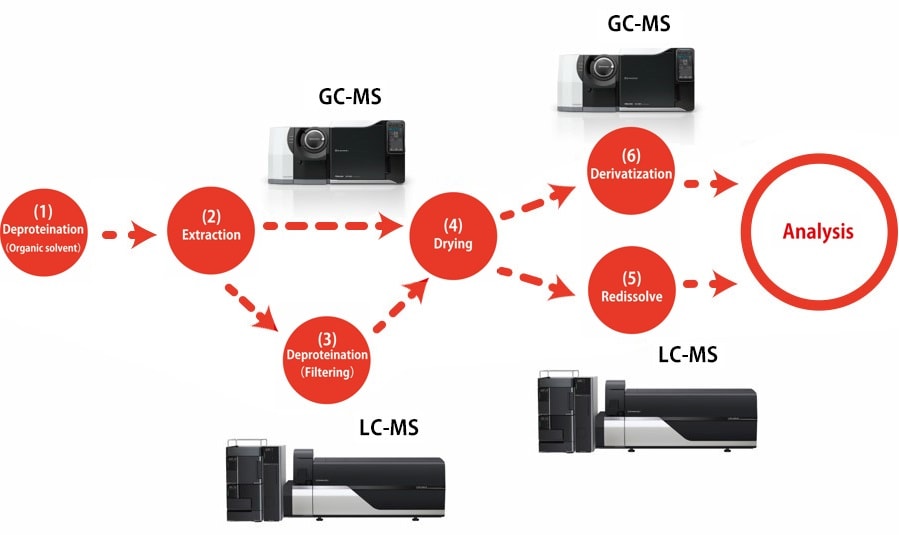
Procédure de prétraitement pour la métabolomique (échantillon biologique)
Procédure de prétraitement du sérum sanguin
Vous trouverez ici un aperçu des procédures de prétraitement pour déterminer les métabolites primaires dans le sérum par GC-MS ou LC-MS. Veuillez vous référer au « Manuel de procédures de prétraitement pour l'analyse des métabolites » pour plus de détails sur les réactifs et l'équipement expérimental utilisés.
Cette méthode *1 est utilisée pour extraire principalement des métabolites hydrophiles en ajoutant un solvant d'extraction constitué d'un mélange d'eau, de méthanol et de chloroforme pour déprotéiner l'échantillon liquide, puis récupérer la couche d'eau. Étant donné que seuls les composés vaporisés sont détectés par l'analyse GC-MS, les composés qui ne se vaporisent pas facilement doivent être dérivés. La dérivatisation est réalisée en deux étapes par méthoximation et triméthylsilylation (TMS).
(1) Déprotéination avec un solvant organique
Recueillir un échantillon de 50 µL de sérum sanguin dans un tube de 1,5 mL (Fig. 1). Si un étalon interne est utilisé, ajoutez l’étalon interne au tube. Ajoutez une certaine quantité de mélange de solvants contenant de l'eau, du méthanol et du chloroforme dans un rapport de 1:2,5:1 (solvant d'extraction) dans le tube. Lorsque la protéine se dénature, le contenu du tube prend une couleur blanc trouble (Fig. 2). Il est pratique que le solvant d’extraction puisse être préparé en grande quantité à l’avance et stocké dans des flacons de réactif de 1 L, ou dans d’autres récipients, à température ambiante. Le solvant d’extraction peut également être ajouté au tube après l’avoir prémélangé avec la solution étalon interne dans un tube de 50 mL. Après avoir soigneusement mélangé avec un mélangeur vortex (Fig. 3), chauffez le mélange à 37 degrés Celsius et agitez-le pendant 30 minutes à environ 1 200 tr/min dans un shaker chauffé (Fig. 4). Une fois l'agitation terminée, centrifugez le mélange pendant trois minutes à 4 degrés Celsius et 16 000 G (Fig. 5). La solution est séparée en deux couches, la protéine dénaturée étant précipitée sur la surface limite entre les couches (Fig. 6). Obtenez 225 µL du surnageant en insérant soigneusement un embout de pipette dans le tube, afin que l'embout n'entre pas en contact avec le précipité ou la couche de chloroforme, et placez-le dans un nouveau tube (Fig. 7).

(2) Extraction de métabolites hydrophiles
Ajouter une certaine quantité d'eau ultra pure dans le nouveau tube contenant le surnageant récupéré. Les protéines restant dans la solution sont dénaturées, donnant à la solution une couleur blanc trouble (Fig. 8). Après avoir bien mélangé au vortex (Fig. 9), centrifugez à nouveau le mélange pendant trois minutes à 4 degrés Celsius et 16 000 G. Après centrifugation (Fig. 10), récupérez le surnageant et placez-le dans un nouveau tube (Fig. 11).

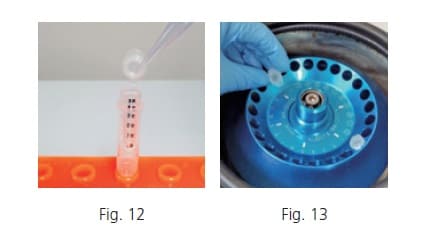
(3) Déprotéination à l'aide d'un filtre d'exclusion de taille (uniquement dans le cas du LCMS)
Dans l'analyse LC-MS, le solvant organique est appliqué comme phase mobile, exposant l'échantillon à un environnement de solvant organique concentré pendant l'analyse. Si des protéines qui n’ont pas été entièrement déprotéinisées précipitent pendant l’analyse, cela pourrait provoquer un blocage de la ligne et arrêter l’analyse. Pour éviter cette situation, une filtration par exclusion de taille est utilisée après l’extraction pour éliminer les protéines. Pour éliminer les protéines dénaturées entre les couches, fixez le filtre d'exclusion de taille à un tube propre (Fig. 12), ajoutez une certaine quantité de surnageant au sommet du filtre et fermez le bouchon. Centrifuger 60 minutes à 4 degrés Celsius et 16 000 G (Fig. 13). Après centrifugation, retirez le filtre du tube.
(4) Séchage
Percez deux ou trois petits trous dans le bouchon du tube de 1,5 mL et coupez le bouchon du tube (Fig. 14). Fixez le capuchon au tube contenant le surnageant collecté (Fig. 15). Utilisez l'évaporateur centrifuge pour évaporer le méthanol de la solution pendant 25 minutes (Fig. 16). Après 25 minutes d'évaporation, placer le tube au congélateur sans changer le bouchon. Laissez reposer pendant environ 15 minutes, puis vérifiez que la solution est complètement congelée. Enfin, séchez-le au lyophilisateur (Fig. 17). S'il est nécessaire de conserver l'échantillon après le prétraitement, conservez l'échantillon séché dans le congélateur pour l'échantillon d'analyse LC-MS et stockez-le dans le dessiccateur à température ambiante pour l'échantillon d'analyse GC-MS. En effet, la dérivatisation est nécessaire pour l'analyse par GC-MS et l'efficacité de la désorption diminue lorsque l'humidité est absorbée.

(5) Redissoudre (uniquement dans le cas du LCMS)
(6) Dérivatisation (uniquement dans le cas du GCMS)
Peser le chlorhydrate de méthoxyamine. Dissoudre le chlorhydrate de méthoxyamine pesé dans la pyridine pour obtenir une concentration de 20 mg/mL (Fig. 20). Préparez suffisamment de solution de méthoxyamine-pyridine pour le nombre donné d’échantillons impliqués, en supposant que 80 µL sont utilisés par tube.
* Le chlorhydrate de méthoxyamine peut être difficile à dissoudre dans certains cas. Si des résidus non dissous sont visibles, utilisez un sonicateur ou un autre moyen pour vous assurer qu'ils sont complètement dissous.
Une substance solide de couleur blanche à jaune blanchâtre s'accrochera aux parois du tube d'échantillon après lyophilisation (Fig. 21). Ajoutez 80 µL de la solution de méthoxyamine-pyridine à 20 mg/mL (Fig. 22) et mélangez-la au sonicateur jusqu'à ce que le résidu soit dispersé (Fig. 23).
* Toute humidité contenue dans l'échantillon diminuera l'efficacité de la dérivatisation, soyez donc particulièrement prudent pour empêcher l'eau de pénétrer dans l'échantillon.
Chauffez et agitez l'échantillon dans le shaker chauffé pendant 90 minutes à 30 degrés Celsius et à environ 1 200 tr/min (Fig. 24). Ajoutez ensuite 40 µL de MSTFA (Fig. 25), chauffez et agitez l'échantillon dans le shaker chauffé pendant 30 minutes supplémentaires à 37 degrés Celsius et environ 1 200 tr/min. S'il reste des résidus, centrifugez à 16 000 G pendant trois minutes (Fig. 26), récupérez le surnageant dans un flacon GC-MS et utilisez-le pour l'analyse (Fig. 27).

*1 : La métabolomique sérique comme nouvelle approche diagnostique du cancer gastro-intestinal.
(Ikeda A, Nishiumi S, Shinohara M, Yoshie T, Hatano N, Okuno T, Bamba T, Fukusaki E, Takenawa T, Azuma T, Yoshida M. Biomed Chromatogr. 2012 mai;26 (5):548-58. doi : 10.1002/bmc.1671. Publication en ligne du 20 juillet 2011.)