Ligne de base du gradient pour l'eau/acétonitrile contenant du TFA
L'élution en gradient (GE) avec de l'eau/acétonitrile contenant de l'acide trifluoroacétique (TFA) est couramment utilisée pour l'analyse ou la fractionnement des peptides et des protéines. Cela peut entraîner une bosse dans la ligne de base et des pics fantômes, rendant difficile la détermination de la manière de traiter les données. Nous allons examiner ce problème sur cette page.
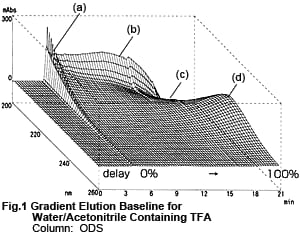
La Fig. 1 montre un chromatogramme 3D obtenu par élution en gradient avec le Liquide A et le Liquide B, avec la concentration du Liquide B augmentée de 0 à 100 %. Le Liquide A est une solution aqueuse de TFA à 0,01 M et le Liquide B est une solution d'acétonitrile de TFA à 0,01 M. Le pic (a) près du moment où le Liquide B atteint pour la première fois le détecteur, la bosse (b) et la dépression (c) près de 200 nm, et la bosse (d) près de 225 nm due à l'augmentation du Liquide B sont clairement montrés.

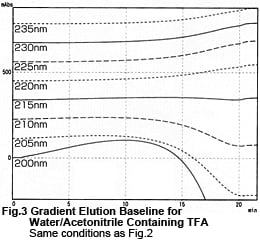
La Fig. 2 montre ce que nous obtenons en retirant la colonne et en effectuant une élution en gradient en utilisant uniquement les tubes. La principale différence est que le pic (a) de la Fig. 1 a disparu. Cela indique que le pic résultait de l'élution du TFA ou des impuretés dans la phase mobile qui étaient retenues dans la colonne. À l'inverse, les bosses (b), (c) et (d) ont été jugées inhérentes à la méthode. La Fig. 3 montre les données de la Fig. 2 sous forme de chromatogrammes. Elle montre les plus petites fluctuations de la ligne de base autour de 215 nm. À de faibles longueurs d'onde, les courbes bombent avant de chuter. À de longues longueurs d'onde, les courbes concaves montent progressivement.
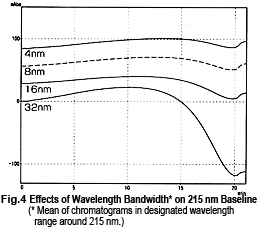
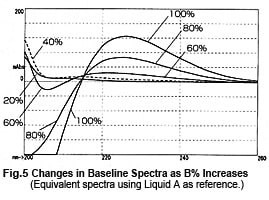
Donc, il pourrait sembler que les mesures peuvent être effectuées en toute sécurité près de 215 nm, mais ce n'est pas nécessairement le cas. La Fig. 4 montre des chromatogrammes de mesures à 215 nm tout en changeant la largeur de bande de longueur d'onde. Elle montre que la ligne de base fluctue considérablement à mesure que la largeur de bande de longueur d'onde s'élargit. Cet effet semble se produire en raison d'un décalage vers le côté des courtes longueurs d'onde. Près de 215 nm, les changements d'absorbance vers l'extrémité des courtes longueurs d'onde sont plus importants que les changements d'absorbance vers l'extrémité des longues longueurs d'onde (Fig. 5). Comme un détecteur UV-VIS à longueur d'onde unique offre normalement une largeur de bande de longueur d'onde d'environ 8 nm, il faut faire attention lors de l'élution en gradient à 50 % ou plus de Liquide B.
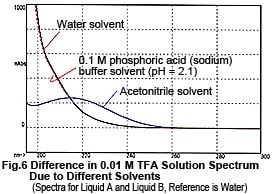
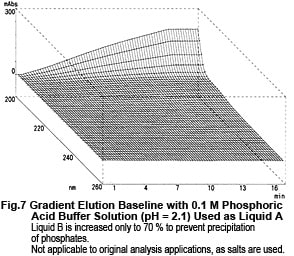
Maintenant, examinons les spectres du Liquide A et du Liquide B. Bien qu'ils contiennent tous deux la même concentration de TFA (0,01 M), les spectres diffèrent considérablement, comme le montre la Fig. 6. Ainsi, les fluctuations de la ligne de base pendant l'élution en gradient décrites ci-dessus ne résultent pas de la proportion de mélange du Liquide A et du Liquide B, mais plutôt des changements dans leurs spectres. Alors, pourquoi le spectre d'absorption change-t-il à mesure que la proportion d'acétonitrile augmente ? Les raisons possibles sont (1) il supprime la dissociation du TFA et (2) une interaction mutuelle entre le TFA et l'acétonitrile. Comme expérience, nous avons maintenu l'état de dissociation du TFA aussi constant que possible. Au lieu de l'eau, nous avons utilisé une solution tampon de phosphate (sodium) à 0,1 M (pH 2,1) contenant du TFA dissous comme solvant pour le Liquide A. (Comme le montre la Fig. 6, le spectre de cette solution tampon est presque identique à celui de l'eau). Puis nous avons effectué une élution en gradient, augmentant la concentration du Liquide B de 0 à 70 %. Aucune fluctuation irrégulière de la ligne de base n'a pu être observée, comme le montre la Fig. 7. Par conséquent, les changements dans les spectres sont supposés être causés par la dissociation du TFA. (L'augmentation du pourcentage d'acétonitrile déplace l'équilibre ci-dessous vers la gauche.)
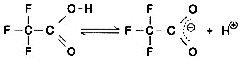
L'utilisation d'un autre acide organique, comme l'acide acétique, au lieu du TFA entraîne des fluctuations de ligne de base similaires. Donc, avant de conclure qu'un problème s'est produit, vérifiez si les fluctuations sont appropriées ou si des problèmes sont survenus avec la qualification ou la quantification.
Référence : G. Winkler, et al., J. Chromatogr., 347 (1985) 83-88.






