Chromatographie par paires d'ions - Différencier l'utilisation des sulfonates d'alkyle et des perchlorates
La chromatographie par paire d'ions (IPC) est une technique utilisée pour séparer les substances chargées. Elle est largement utilisée pour analyser sélectivement les acides et les bases, en particulier avec la chromatographie en phase inverse. Cependant, les clients se plaignent souvent que la mise en place des conditions analytiques pour l'IPC peut être problématique ou que la reproductibilité est difficile à obtenir. Ces problèmes surviennent probablement en raison d'une prise en compte insuffisante de la sélection des ions pairs (ions de charge opposée aux composants cibles) à ajouter aux phases mobiles et de leurs conditions d'utilisation. Par conséquent, l'explication suivante utilise des sulfonates d'alkyle et des perchlorates comme exemple, qui sont couramment utilisés dans l'IPC des bases et des cations, pour donner un aperçu de la façon de déterminer lequel utiliser en fonction de leurs caractéristiques respectives.
Sulfonate d'Alkyle
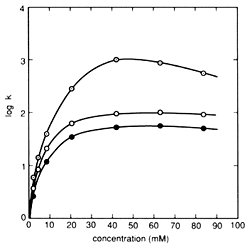
Fig. 1 Influence de la Concentration d'Ions Pairs sur la Rétention des Composants Colonne : STR ODS-M, Phase mobile : solution tampon citrate (sodium) 10 mM contenant du sodium 1-octanesulfonate (pH 4,6) / solution d'acétonitrile = 5/1 (v/v), Débit : 1,0 mL/min, Température de la colonne : 40 °C, et Détection : 280 nm. Composants : ○(Gris) - Dopamine, ○ - Épinéphrine, ● - Norépinéphrine
Le sulfonate d'alkyle est un ion pair typique utilisé dans l'IPC des substances à charge positive. Normalement, le sulfonate d'alkyle avec 5 à 12 carbones est utilisé comme sel de sodium. En général, le mécanisme de séparation utilisé dans la chromatographie par paire d'ions en phase inverse est expliqué comme consistant en deux processus - un processus de distribution par paire d'ions, qui associe les composants cibles aux ions pairs et les capture dans une phase solide, et un processus d'échange d'ions, qui retient les composants cibles par interaction ionique avec les ions pairs adsorbés de manière hydrophobe à la phase solide. Cependant, dans le cas du sulfonate d'alkyle, le mécanisme principal est un processus d'échange d'ions. Par conséquent, plus le nombre de carbones dans le sulfonate d'alkyle est élevé, plus l'effet de rétention sur le composant est fort. De plus, pour le même type de sulfonate d'alkyle, plus la concentration de solvant organique dans la phase mobile est faible, plus la rétention est forte. (Si un sulfonate d'alkyle avec un grand nombre de carbones est utilisé avec une concentration extrêmement faible de solvant organique, un mode pseudo-échange d'ions se produit, où une fois l'équilibre atteint, les composants cibles peuvent être retenus sans ajouter d'ions pairs à la phase mobile.) La concentration d'ions pairs affecte également la rétention des composants, mais les surfactants comme les sulfonates d'alkyle présentent une relation unique entre la concentration et le comportement de rétention. Cette relation est illustrée à la Figure 1. Dans les zones où la concentration est relativement faible, la rétention des composants augmente de manière linéaire, mais une fois qu'elle devient saturée à une concentration donnée (appelée "point de repli"), le niveau de rétention inverse sa direction et commence à diminuer. Cela s'explique par la formation de micelles par le sulfonate d'alkyle, entraînant une phase hydrophobe secondaire au sein de la phase mobile. Par conséquent, il existe une plage limitée de concentration d'ions pairs pouvant être utilisée pour l'IPC.
Perchlorate
Contrairement aux sulfonates d'alkyle, les perchlorates (normalement utilisés comme sel de sodium) ne sont pas eux-mêmes hydrophobes. Par conséquent, ils ne peuvent pas être utilisés à des fins d'échange ionique. Néanmoins, comme les perchlorates ont un grand rayon ionique, ils forment facilement des paires d'ions et, par conséquent, peuvent être considérés complètement en termes de processus de distribution par paire d'ions. Par conséquent, ils n'ont pas de point de repli dans la relation entre la concentration et la rétention des composants, donc la rétention augmente progressivement à mesure que la concentration augmente. De plus, l'effet de rétention des composants est uniforme, quelle que soit la concentration de solvant organique.
Cependant, comme la rétention des composants par les perchlorates est basée sur les propriétés hydrophobes des composants eux-mêmes qui apparaissent lorsque leur charge est annulée par la formation de paires d'ions, elle peut ne pas être applicable à certains composants.
Différencier l'Utilisation des Ions Pairs
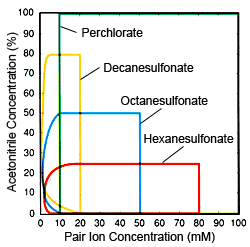
Fig. 2 Plage de Concentrations d'Ions et de Solvant Organique (acetonitrile) Efficace pour la Chromatographie par Paire d'Ions Rouge : Hexanesulfonate, Bleu : Octanesulfonate, Jaune : Décanesulfonate, Vert : Perchlorate
En fonction des caractéristiques des ions pairs respectifs, la description suivante présente des considérations pratiques pour différencier quand utiliser différents ions pairs. L'objectif fondamental de l'utilisation de l'IPC et de ces ions pairs est d'augmenter la force de rétention des bases et des cations, mais ils sont également utilisés pour supprimer l'étalement des pics (phénomène courant dans les colonnes ODS et autres colonnes en gel de silice). Pour le premier de ces objectifs, le sulfonate d'alkyle est plus utile, car il peut contrôler la rétention des composants sur une large plage. Pour le deuxième objectif, les perchlorates sont préférables, car ils sont plus faciles à utiliser et peuvent être utilisés pour n'importe quel composant. Par conséquent, en général, les sulfonates d'alkyle sont préférés pour la rétention des composants, tandis que les perchlorates sont préférés pour supprimer l'étalement. Cependant, si les composants cibles sont des ions hydrophobes, il n'y a pas de différence significative entre les sulfonates d'alkyle et les perchlorates. Si un sulfonate d'alkyle est utilisé, la concentration du solvant organique dans la phase mobile est extrêmement importante lors de la détermination du nombre de carbones pour le sulfonate d'alkyle. Éluer les composants à des positions fixes en utilisant des concentrations fixes de solvant organique nécessite que plus le nombre de carbones est faible, plus la concentration est élevée. Cependant, comme indiqué à la Figure 1, il existe une limite aux concentrations d'ions pairs, donc si la concentration de solvant organique est élevée, les sulfonates d'alkyle avec peu de carbones ne peuvent pas être utilisés. Cependant, cela ne signifie pas que des nombres de carbones plus élevés sont nécessairement préférables. En fait, moins de carbones est un avantage en termes d'équilibre de la colonne. Plus la concentration de solvant organique est faible et plus la concentration d'ions pairs est faible, plus il faut de temps pour que la colonne atteigne l'équilibre, mais si un sulfonate d'alkyle avec un nombre élevé de carbones est utilisé avec une faible concentration de solvant organique, il faudra beaucoup de temps pour que la colonne se stabilise car une faible concentration est utilisée, bien sûr. Par conséquent, il est important de décider de la concentration de solvant organique avant de sélectionner le nombre de carbones. La Figure 2 montre des lignes directrices générales pour déterminer les conditions d'utilisation (concentrations d'ions pairs et concentrations de solvant organique) efficaces pour les ions pairs respectifs. Utilisez-la comme référence pour sélectionner les ions pairs.
Détermination des Concentrations de Solvant Organique
Déterminez la concentration de solvant organique, en considérant d'abord l'hydrophobicité d'origine des composants cibles. En d'autres termes, considérez dans quelle mesure la phase mobile retient les composants cibles sans inclure d'ions pairs. Par exemple, si l'IPC doit être utilisée pour éluer un composant en 10 minutes, les conditions de phase mobile doivent permettre d'éluer le composant en 10 minutes sans inclure d'ions pairs. Par conséquent, la limite inférieure de la concentration de solvant organique est la concentration qui permet d'éluer le composant en 10 minutes, il est donc nécessaire de fixer la concentration égale ou supérieure à cela. Si l'IPC est utilisée pour simplement augmenter la force de rétention d'un composant, toute concentration appropriée égale ou supérieure à cela peut être sélectionnée, mais si des composants avec une hydrophobicité similaire doivent être séparés, la concentration doit être maintenue aussi proche que possible de la limite inférieure, car plus la concentration de solvant organique est élevée, plus la rétention relative est faible. Si les composants cibles incluent non seulement des bases et des cations, mais aussi des substances neutres ou des acides, la concentration qui peut retenir adéquatement ces composants est considérée comme la limite supérieure.






