Méthodes d'extraction
Il n'existe pas de méthode standard généralement acceptée pour l'extraction des caroténoïdes en laboratoire (Rivera et al., 2012). Cela est dû à la grande variété de produits alimentaires contenant des caroténoïdes, aux différents génotypes d'un organisme ou d'un produit ainsi qu'aux différences potentielles entre les différentes parties du même aliment ou échantillon. Cependant, la plupart des méthodes d'extraction suivent un chemin commun consistant à libérer les composants souhaités de leurs matrices en perturbant les tissus, suivi de l'élimination des composants indésirables et d'une extraction liquide-liquide ou liquide-solide (Figure 1).
Bien que rarement rapportée dans les études sur les caroténoïdes, l'extraction en phase solide (SPE) avec des adsorbants typiques comme C30 et C18 pourrait également être utilisée. De nombreux solvants organiques différents ont été utilisés dans l'analyse des caroténoïdes et la sélection du bon solvant n'est pas toujours facile à réaliser. Outre les difficultés expliquées au début de cette section, les différentes polarités des caroténoïdes existants et la structure de la matrice analytique et de ses composants jouent également un rôle important dans le choix d'un solvant pour l'extraction. Habituellement, les solvants non polaires comme l'hexane sont un bon choix pour les caroténoïdes non polaires (carotènes) ou estérifiés, tandis que les solvants polaires comme l'éthanol et l'acétone sont plus appropriés pour les caroténoïdes polaires (xanthophylles). De plus, la susceptibilité des caroténoïdes à la lumière, à la chaleur, à l'acide ou à l'exposition à l'oxygène doit également être prise en compte lors du développement d'une méthode d'extraction des caroténoïdes.
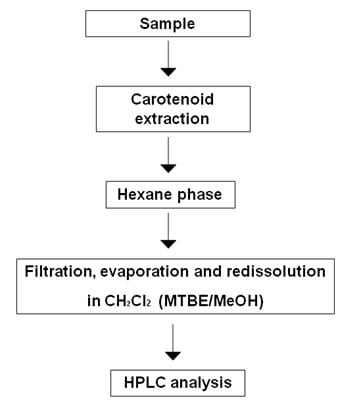
Figure 1







