pKa et équilibre de dissociation
1. pH
Lorsque de l'acide chlorhydrique ou un autre acide est ajouté à de l'eau, le niveau de pH diminue. L'acidité d'une solution est déterminée par sa concentration en protons (ions hydrogène) ([H+]), où le pH fournit un indice simple pour exprimer le niveau de [H+]. Le pH est indiqué en termes de l'expression suivante, où un nombre plus petit signifie une acidité plus forte (une concentration en protons plus élevée).
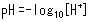
Un point important concernant le pH est qu'un changement de seulement 1 dans la valeur du pH équivaut à un changement de 10 fois dans la concentration en protons.
Remarque : Le niveau d'activité devrait être utilisé plutôt que la concentration, mais la concentration a été utilisée au lieu de l'activité car elle correspond souvent au niveau d'activité dans les concentrations analytiques et c'est plus simple (il en va de même ci-dessous).
2. pKa et équilibre de dissociation
Les acides comprennent des acides forts, qui se dissocient complètement dans l'eau, et des acides faibles, qui ne se dissocient que partiellement. Lorsqu'un acide se dissocie, il libère un proton pour rendre la solution acide, mais les acides faibles ont à la fois un état dissocié (A-) et un état non dissocié (AH) qui coexistent selon l'équation d'équilibre de dissociation suivante.
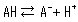
Le rapport de concentration des deux côtés est constant étant donné des conditions analytiques fixes et est appelé constante de dissociation acide (Ka). Ka est défini par l'équation suivante.
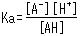
Les crochets carrés indiquent la concentration des composants respectifs. Sur la base de cette équation, Ka exprime à quel point l'acide libère facilement un proton (en d'autres termes, sa force en tant qu'acide). De plus, l'équation montre comment l'état de dissociation des acides faibles varie en fonction du niveau de [H+] dans la solution.
Les acides carboxyliques (contenant -COOH), tels que les acides acétique et lactique, ont normalement une constante Ka d'environ 10-3 à 10-6. Par conséquent, exprimer l'acidité uniquement en termes de constante Ka peut être peu pratique et pas très intuitif.
C'est pourquoi le pKa a été introduit comme un indice pour exprimer l'acidité des acides faibles, où le pKa est défini comme suit.
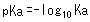
Par exemple, la constante Ka pour l'acide acétique (CH3COOH) est 0.0000158 (= 10-4.8), mais la constante pKa est 4.8, ce qui est une expression plus simple. De plus, plus la valeur de pKa est petite, plus l'acide est fort. Par exemple, la valeur de pKa de l'acide lactique est d'environ 3.8, ce qui signifie que l'acide lactique est un acide plus fort que l'acide acétique.
3. pKa et capacité tampon
Un autre point important est la relation entre le pH et le pKa d'un acide. Cette relation est décrite par l'équation suivante.
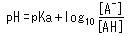
Cette équation peut être réarrangée comme suit.
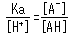
Cela montre comment le pKa et le pH sont égaux lorsque la moitié de l'acide a été dissociée ([A-]/[AH] = 1). Si le pH change de 1 près de la valeur du pKa, l'état de dissociation de l'acide change de manière extrêmement importante.
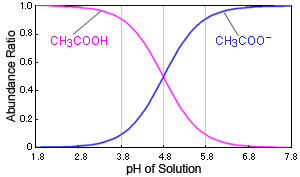
Fig. Relation entre le pH de la solution et l'état de dissociation de l'acide acétique
Dans le cas de l'acide acétique, par exemple, si le pH de la solution change près de 4.8, cela provoque un grand changement dans la présence de l'acide acétique. Lorsque le pH est de 3.8, plus de 90 % existent sous forme de molécules d'acide acétique (CH3COOH), mais à un pH de 5.8, plus de 90 % existent sous forme d'ions acétate (CH3COO-).
Inversement, pour changer le niveau de pH près de la valeur du pKa d'un acide, l'état de dissociation de l'acide doit être modifié de manière significative, ce qui nécessite d'utiliser une quantité extrêmement importante d'acide ou de base. La capacité d'une substance à maintenir le pH de telles solutions est appelée sa capacité tampon, où plus le pKa et le pH sont proches, plus la capacité tampon est élevée. Par conséquent, lors de la sélection d'une solution tampon, qui est largement utilisée en chromatographie liquide, une solution tampon acide ou basique avec une valeur de pKa proche du niveau de pH cible est sélectionnée pour maximiser cette capacité tampon.






