Matériaux d'emballage des microparticules
7. Chaleur de réaction lors du mélange avec de l'eau
Pour l'élution isocratique, de l'eau et un solvant organique pré-mélangés dans la bouteille de réserve sont utilisés comme phase mobile. Lorsqu'il est mélangé avec de l'eau, le méthanol réagit de manière exothermique. En revanche, l'acétonitrile réagit de manière endothermique et donc la température du liquide descend en dessous de la température ambiante. À mesure que le mélange d'acétonitrile revient progressivement à la température ambiante, des bulles ont tendance à se former dans le liquide. De plus, si le mélange est utilisé comme phase mobile avant d'avoir retrouvé la température ambiante, les temps de rétention seront plus rapides et ne se stabiliseront qu'à mesure que le liquide approche de la température ambiante. Pendant ce temps, le méthanol produit de la chaleur lorsqu'il est mélangé avec de l'eau, ce qui a un effet de dégazage. Cela signifie que préparer un mélange d'eau et de méthanol comme phase mobile nécessite moins de précautions que dans le cas de l'acétonitrile.
Résumé
Ci-dessus, nous avons introduit 7 points clés pour choisir entre le méthanol et l'acétonitrile comme solvant organique dans l'analyse HPLC. Du point de vue du flux de travail analytique, il existe des différences en termes de pression de colonne, d'absorption UV et de compatibilité des tampons, et en ce qui concerne la séparation analytique, il convient de prêter attention à la force d'élution, à la sélectivité de séparation et au comportement de rétention. Comprendre ces différences dans les propriétés chimiques du méthanol et de l'acétonitrile, ainsi que les combinaisons de colonnes appropriées, réduit le risque de problèmes dans l'analyse HPLC et améliore l'efficacité du développement de méthodes.
6. Précipitation lors du mélange avec un tampon
Dans la chromatographie en phase inverse, des tampons sont utilisés avec des phases mobiles à base d'eau. Ils sont mélangés avec des solvants organiques pour une utilisation, mais selon le type de tampon et de solvants organiques, une quantité trop élevée de solvants organiques peut provoquer la précipitation du sel de tampon. Les tableaux 1 et 2 montrent si la précipitation se produit pour des mélanges de tampons couramment utilisés avec de l'acétonitrile ou du méthanol respectivement. Les valeurs dans le tableau montrent le rapport (v/v) auquel la précipitation commence à se produire. Nous pouvons voir que pour certains tampons, il n'y a pas de précipitation pour l'un ou l'autre solvant organique, mais en général, le méthanol provoque moins de précipitation.
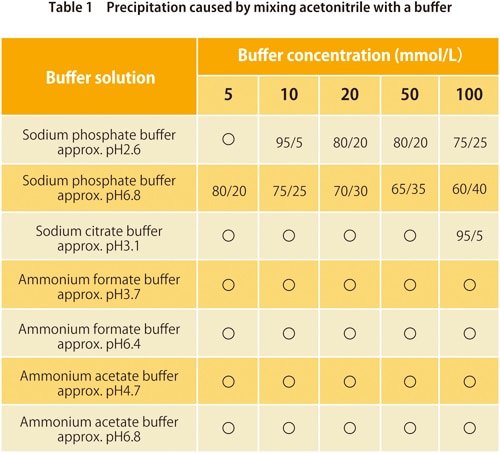
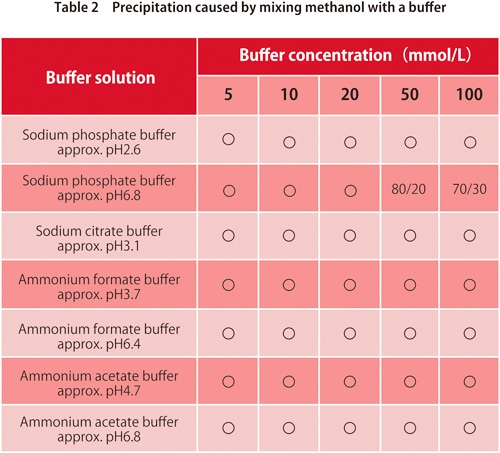
*Les valeurs indiquées dans le tableau peuvent varier en fonction des conditions de laboratoire.
** "〇" signifie pas de précipitation.
7. Chaleur de réaction lors du mélange avec de l'eau
Pour l'élution isocratique, de l'eau et un solvant organique pré-mélangés dans la bouteille de réserve sont utilisés comme phase mobile. Lorsqu'il est mélangé avec de l'eau, le méthanol réagit de manière exothermique. En revanche, l'acétonitrile réagit de manière endothermique et donc la température du liquide descend en dessous de la température ambiante. À mesure que le mélange d'acétonitrile revient progressivement à la température ambiante, des bulles ont tendance à se former dans le liquide. De plus, si le mélange est utilisé comme phase mobile avant d'avoir retrouvé la température ambiante, les temps de rétention seront plus rapides et ne se stabiliseront qu'à mesure que le liquide approche de la température ambiante. Pendant ce temps, le méthanol produit de la chaleur lorsqu'il est mélangé avec de l'eau, ce qui a un effet de dégazage. Cela signifie que préparer un mélange d'eau et de méthanol comme phase mobile nécessite moins de précautions que dans le cas de l'acétonitrile.
Résumé
Ci-dessus, nous avons introduit 7 points clés pour choisir entre le méthanol et l'acétonitrile comme solvant organique dans l'analyse HPLC. Du point de vue du flux de travail analytique, il existe des différences en termes de pression de colonne, d'absorption UV et de compatibilité des tampons, et en ce qui concerne la séparation analytique, il convient de prêter attention à la force d'élution, à la sélectivité de séparation et au comportement de rétention. Comprendre ces différences dans les propriétés chimiques du méthanol et de l'acétonitrile, ainsi que les combinaisons de colonnes appropriées, réduit le risque de problèmes dans l'analyse HPLC et améliore l'efficacité du développement de méthodes.






