7 Principales différences dans l'utilisation du méthanol et de l'acétonitrile
Le méthanol et l'acétonitrile sont des acides organiques couramment utilisés comme phase mobile en chromatographie en phase inverse. Les propriétés de ces deux acides organiques diffèrent, et ci-dessous, nous décrivons 7 différences clés à garder à l'esprit lors de l'utilisation du méthanol ou de l'acétonitrile pour l'analyse.
1. Pression de colonne
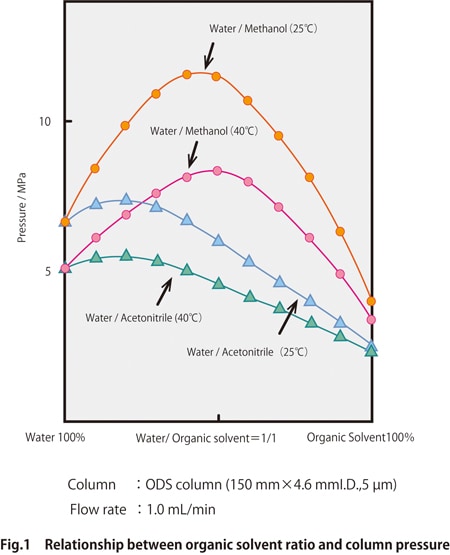
La Fig. 1 montre un exemple du rapport de solvant et de la pression de livraison du solvant pour des mélanges d'eau/acétonitrile et d'eau/méthanol.
La pression tend également à diminuer à mesure que la viscosité du solvant diminue en raison de l'augmentation de la température de la colonne. En réglant la température de la colonne entre 25 et 40 °C et en comparant les pressions de colonne pour l'eau/acétonitrile et l'eau/méthanol, nous pouvons voir que la pression est plus élevée pour le méthanol. Lors du passage de la phase mobile de l'acétonitrile au méthanol, la résistance à la pression de l'équipement et de la colonne doit être vérifiée à nouveau.
2. Spectre d'absorption
Les Figs. 2 et 3 montrent les spectres d'absorption de l'acétonitrile et du méthanol, y compris les solvants de qualité commerciale pour usage HPLC et les solvants de haute qualité. Les solvants organiques commerciaux pour HPLC ont été traités pour éliminer pratiquement toutes les impuretés et afficher une absorbance dans des limites définies entre des longueurs d'onde spécifiées. On peut voir sur la Fig. 2 que l'absorbance de l'acétonitrile de qualité HPLC est particulièrement faible à des longueurs d'onde courtes. Cet acétonitrile de qualité HPLC est donc adapté à l'analyse à haute sensibilité avec détection UV dans la région des courtes longueurs d'onde. De plus, les solvants organiques qui ont été traités pour l'analyse LCMS ont à la fois des impuretés absorbantes UV et des métaux résiduels éliminés. Cela permet d'éviter le bruit de fond spécifique à l'analyse LCMS. Lors du changement du solvant organique de l'acétonitrile au méthanol, des pics fantômes peuvent être détectés lors de l'analyse par gradient en raison des conditions analytiques dans la plage de longueurs d'onde UV courtes. Dans ce cas, nous recommandons de reconsidérer la qualité du solvant. Si la cause des pics fantômes n'est pas claire et pose des problèmes dans les résultats analytiques, essayez le Ghost Trap DS, qui élimine les impuretés des solvants organiques.
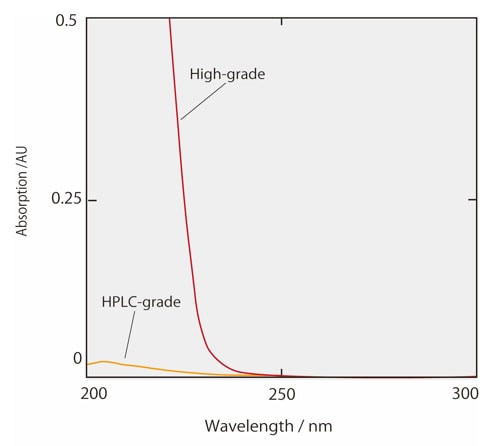
Fig.2 Spectre d'absorption de l'acétonitrile
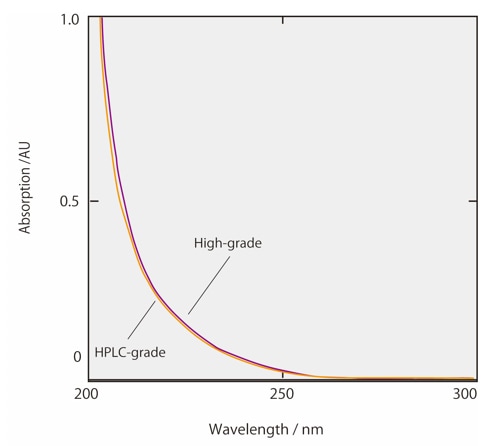
Fig.3 Spectre d'absorption du méthanol
3. Force d'élution
La Fig. 4 montre un exemple de séparation des parabènes, qui est l'acide p-hydroxybenzoïque, avec une colonne ODS. On peut voir que lorsque l'acétonitrile et le méthanol sont mélangés avec de l'eau dans le même rapport, une phase mobile à base d'acétonitrile présente une plus grande force d'élution. Le nomogramme de la Fig. 5 montre les rapports de méthanol et d'acétonitrile à l'eau avec une force de solvant équivalente, utile pour le calcul approximatif de la force d'élution lors du changement entre ces solvants. Si nous avons précédemment utilisé l'acétonitrile comme phase mobile avec un rapport à l'eau de 50/50 (v/v), lors du passage au méthanol, le rapport équivalent méthanol/eau serait de 60/40 (v/v).
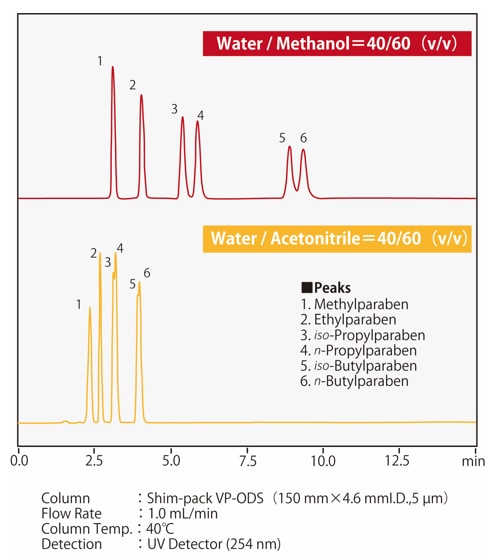
Fig. 4 Comparaison de la force d'élution du méthanol et de l'acétonitrile
(p-hydroxybenzoïque ; parabènes)
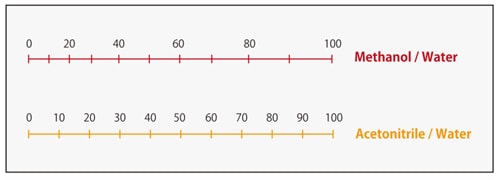
Fig. 5 Nomogramme de la force du solvant pour la chromatographie en phase inverse
(tiré de "Practical HPLC" Method Development)
4. Sélectivité de séparation
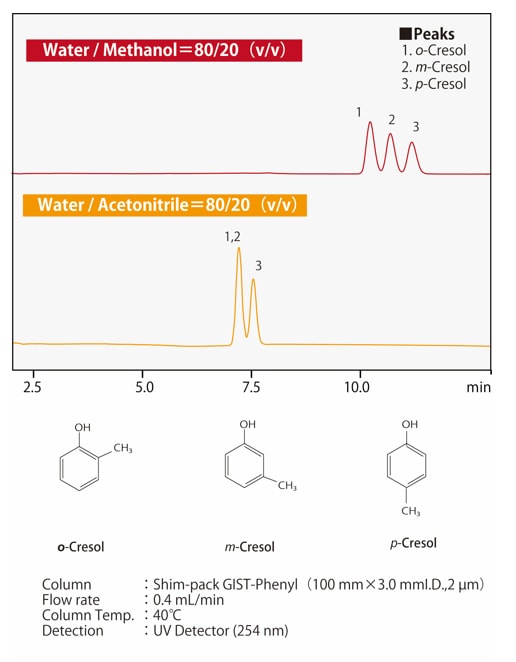 Fig. 6 Différence de sélectivité entre le méthanol et l'acétonitrile
Fig. 6 Différence de sélectivité entre le méthanol et l'acétonitrile(pour les isomères positionnels du cresol)
La sélectivité de séparation de l'acétonitrile et du méthanol diffère, mais comme la sélectivité dépend des propriétés du composé dissous, il n'est pas vrai que la sélectivité est toujours plus élevée pour l'un ou l'autre. Dans la séparation des isomères positionnels, les colonnes phényles peuvent être les plus appropriées parmi les colonnes pour la chromatographie en phase inverse. En plus des interactions hydrophobes, les interactions π-π de la phase stationnaire phénylique contribuent à la séparation. La Fig. 6 montre un exemple de la séparation des isomères positionnels du cresol. L'acétonitrile (CH3-C≡N) a une liaison triple C-N et donc des électrons π, tandis que le méthanol (CH3-OH) n'a pas d'électrons π. Pour une colonne phénylique, l'utilisation du méthanol comme phase mobile permet des interactions π-π, ce qui améliore la séparation.
5. Comportement de rétention
Le méthanol et l'acétonitrile ont des propriétés chimiques différentes. Le méthanol est un solvant protique, tandis que l'acétonitrile est un solvant non-protique, donc nous savons que leur comportement d'élution différera. Si une séparation adéquate ne peut pas être obtenue avec une phase mobile à base d'acétonitrile, passer à une phase mobile à base de méthanol pour changer l'ordre d'élution est une possibilité utile pour le développement de méthodes.
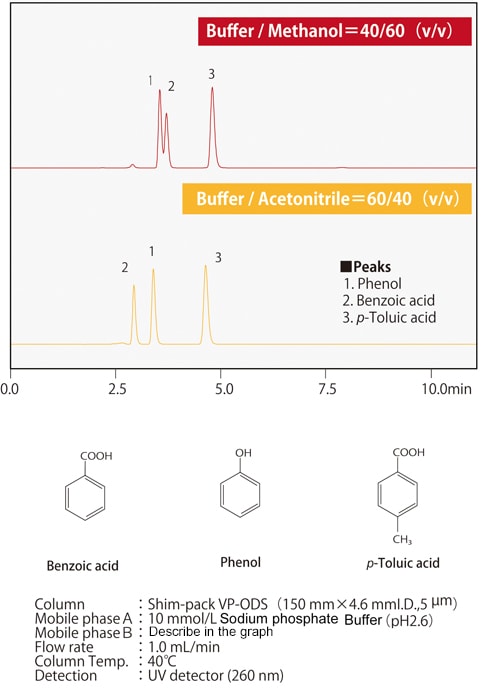 Fig. 7 Différences dans la sélectivité d'élution entre le méthanol et l'acétonitrile
Fig. 7 Différences dans la sélectivité d'élution entre le méthanol et l'acétonitrileLa Fig. 7 montre un exemple de séparation par méthanol ou acétonitrile de composés dans lesquels un atome d'hydrogène d'un cycle benzénique est substitué par un groupe carboxyle ou un groupe hydroxyle. Lorsque les trois composés sont retenus de manière équivalente, on peut voir que l'ordre d'élution du phénol et de l'acide benzoïque change en fonction du solvant utilisé. Selon le type de colonne, il peut y avoir des effets secondaires provenant des groupes fonctionnels polaires du matériau de remplissage, en plus des groupes fonctionnels chimiquement modifiés tels que les groupes ODS et C8 (octyle). Il existe également des cas où les solvants organiques et les effets secondaires des groupes fonctionnels ont ensemble un effet positif. Les Figs. 8 et 9 montrent la séparation de 13 antibiotiques céphém utilisant une colonne en phase inverse et de l'acétonitrile ou du méthanol respectivement, avec les mêmes conditions analytiques dans les deux cas. La rétention et l'ordre d'élution diffèrent selon que l'acétonitrile ou le méthanol est utilisé. Nous savons également que l'ordre d'élution est différent selon la phase stationnaire. Par exemple, en comparant les colonnes ODS et C8, la colonne C8 aura généralement des valeurs de rétention plus faibles. Cependant, en raison des groupes fonctionnels polaires du matériau de remplissage, il n'est pas simplement vrai que la rétention est toujours plus faible ; le comportement de rétention diffère également. Étant donné que le comportement de rétention est affecté par ces divers facteurs, il est nécessaire d'essayer différentes combinaisons de phases mobiles et stationnaires afin d'optimiser les conditions d'analyse.
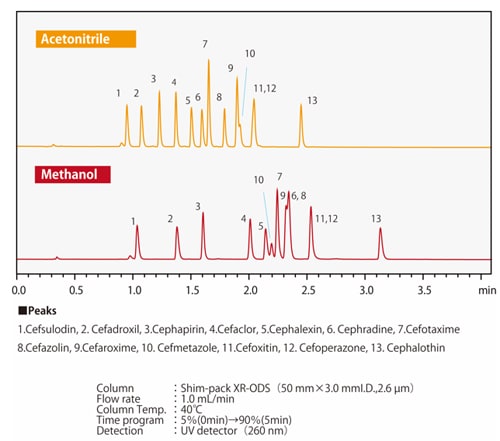
Fig. 8 Séparation des antibiotiques céphém utilisant une colonne ODS
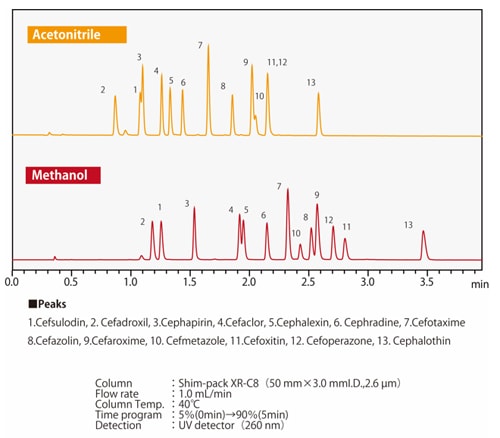
Fig. 9 Séparation des antibiotiques céphém utilisant une colonne C8
6. Précipitation lors du mélange avec un tampon
Dans la chromatographie en phase inverse, des tampons sont utilisés avec des phases mobiles à base d'eau. Ils sont mélangés avec des solvants organiques pour une utilisation, mais selon le type de tampon et de solvants organiques, une quantité trop élevée de solvants organiques peut provoquer la précipitation du sel de tampon. Les tableaux 1 et 2 montrent si la précipitation se produit pour des mélanges de tampons couramment utilisés avec de l'acétonitrile ou du méthanol respectivement. Les valeurs dans le tableau montrent le rapport (v/v) auquel la précipitation commence à se produire. Nous pouvons voir que pour certains tampons, il n'y a pas de précipitation pour l'un ou l'autre solvant organique, mais en général, le méthanol provoque moins de précipitation.
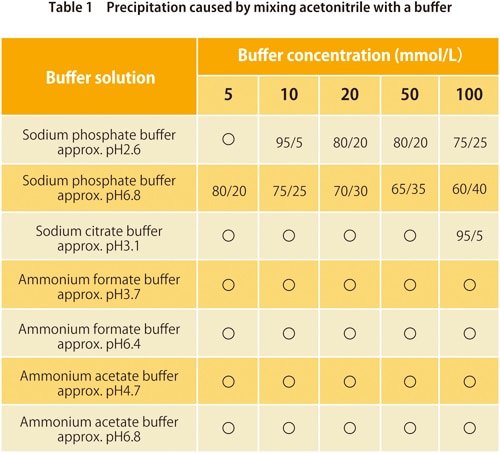
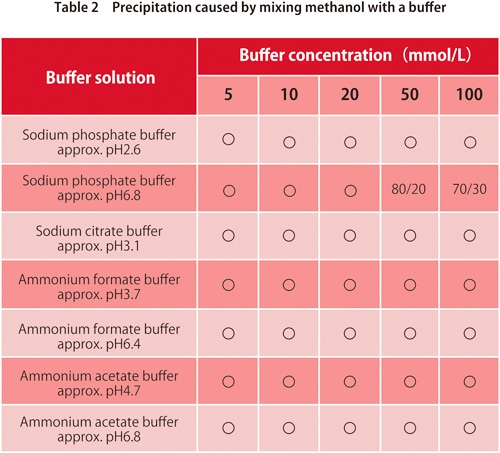
*Les valeurs indiquées dans le tableau peuvent varier en fonction des conditions de laboratoire.
** "〇" signifie pas de précipitation.
7. Chaleur de réaction lors du mélange avec de l'eau
Pour l'élution isocratique, de l'eau et un solvant organique pré-mélangés dans la bouteille de réserve sont utilisés comme phase mobile. Lorsqu'il est mélangé avec de l'eau, le méthanol réagit de manière exothermique. En revanche, l'acétonitrile réagit de manière endothermique et donc la température du liquide descend en dessous de la température ambiante. À mesure que le mélange d'acétonitrile revient progressivement à la température ambiante, des bulles ont tendance à se former dans le liquide. De plus, si le mélange est utilisé comme phase mobile avant d'avoir retrouvé la température ambiante, les temps de rétention seront plus rapides et ne se stabiliseront qu'à mesure que le liquide approche de la température ambiante. Pendant ce temps, le méthanol produit de la chaleur lorsqu'il est mélangé avec de l'eau, ce qui a un effet de dégazage. Cela signifie que préparer un mélange d'eau et de méthanol comme phase mobile nécessite moins de précautions que dans le cas de l'acétonitrile.
Résumé
Ci-dessus, nous avons introduit 7 points clés pour choisir entre le méthanol et l'acétonitrile comme solvant organique dans l'analyse HPLC. Du point de vue du flux de travail analytique, il existe des différences en termes de pression de colonne, d'absorption UV et de compatibilité des tampons, et en ce qui concerne la séparation analytique, il convient de prêter attention à la force d'élution, à la sélectivité de séparation et au comportement de rétention. Comprendre ces différences dans les propriétés chimiques du méthanol et de l'acétonitrile, ainsi que les combinaisons de colonnes appropriées, réduit le risque de problèmes dans l'analyse HPLC et améliore l'efficacité du développement de méthodes.






