2-3) Mélanges de solvants
La solubilité saturée des gaz varie en fonction du type de liquide. En général, les gaz ayant une polarité plus faible ont tendance à se dissoudre plus facilement dans des solvants de polarité plus faible. La figure 4 montre que le benzène et le méthanol ont à peu près la même quantité de gaz dissous par volume. Si cela est calculé en termes de quantité dissoute par mole de solvant, en d'autres termes, la fraction molaire, il est clair que plus la polarité du solvant est faible, plus le taux de dissolution est élevé.
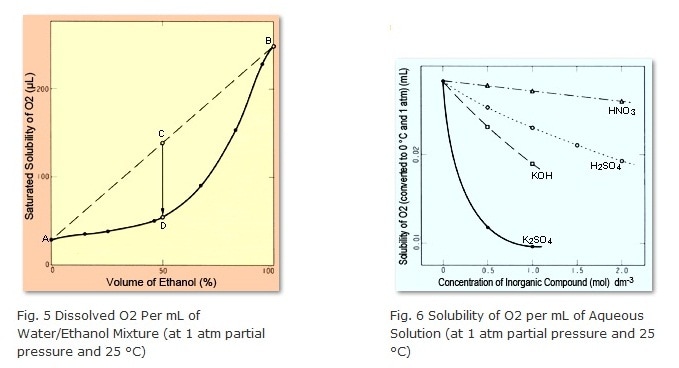
Que se passe-t-il alors pour la solubilité saturée si différents solvants sont mélangés ? La réponse est qu'en général, la quantité dissoute dans la solution mélangée est inférieure à la somme des quantités pour les solvants individuels. La figure 5 montre la quantité d'O2 dissous dans un mélange d'eau et d'éthanol (à une pression partielle de 1 atmosphère). Le point A indique la quantité d'O2 dissous dans 100 % d'eau, tandis que le point B indique la quantité d'O2 dissous dans 100 % d'éthanol. Lorsque des quantités égales d'eau et d'éthanol sont mélangées, la solution contient une quantité d'O2 correspondant au point C, mais la solubilité saturée pour cette solution est seulement au point D. Par conséquent, la différence de quantité d'O2 entre les points C et D se manifeste sous forme de bulles. La même chose se produit pour les mélanges eau/méthanol et eau/acétonitrile, par rapport à la solubilité saturée de l'air.
Remarque : 1 atmosphère (1 atm) = 1,013 × 105 Pa
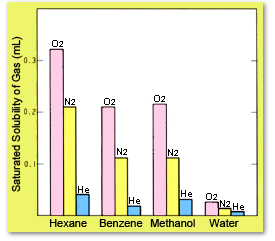
Fig. 4 Gaz dissous par mL de solvant (à 1 atm de pression partielle et 25 °C)
Des bulles peuvent même se former si les deux solvants mélangés sont de l'eau. Cela est dû au fait que la solubilité saturée de l'air diminue généralement avec l'augmentation des concentrations de sel. Cependant, cette relation n'est pas linéaire, mais plutôt courbée vers le bas, comme le montre la figure 6.
Documentation de référence
S.R. Bakalyar, M.P.T Bradley, et R. Honganen, J. Chromatogr., 158, 277-293 (1978)
Kagaku Binran, Kiso-hen II 8.7 Yokaido (Manuel de chimie générale, Fondamentaux vol. II, 8.7 Solubilité), édité par la Société chimique du Japon, publié par Maruzen Co. Ltd. (1984)






