Préparation des solutions tampons
Le pH de la phase mobile (éluant) est ajusté pour améliorer la séparation des composants et prolonger la durée de vie de la colonne. Cet ajustement de pH ne devrait pas simplement consister à ajouter un acide ou une base, mais à utiliser des solutions tampons, autant que possible. Une bonne reproductibilité de séparation (stabilité) peut ne pas être atteinte si des solutions tampons ne sont pas utilisées.
Une solution tampon est préparée comme une combinaison d'acides faibles et de leurs sels (sels de sodium, etc.) ou d'alcools faibles et de leurs sels. Les méthodes de préparation courantes incluent : 1) ajouter un acide (ou une base) à une solution aqueuse d'un sel tout en mesurant le pH avec un pH-mètre et 2) préparer une solution aqueuse d'acide avec la même concentration que le sel et mélanger tout en mesurant le pH avec un pH-mètre. Cependant, si la solution tampon est utilisée comme phase mobile HPLC, même de petites erreurs de pH peuvent entraîner des problèmes de reproductibilité de séparation. Par conséquent, il est important d'inspecter et de calibrer rigoureusement tout pH-mètre utilisé. Cette page présente une méthode qui ne repose pas sur un pH-mètre. La méthode implique de peser des quantités fixes théoriquement calculées d'un sel et d'un acide (ou d'une base) comme indiqué dans le tableau ci-dessous. Considérez les points importants ci-dessous.
Dénommer les solutions tampons
Une solution tampon dénommée "solution tampon d'acide phosphorique (sodium) à 100 mM, pH = 2.1," par exemple, contient de l'acide phosphorique comme acide, du sodium comme contre-ion, une concentration totale de 100 mM du groupe acide phosphorique et un pH de solution tampon garanti de 2.1.
Action tampon maximale proche du pKa de l'acide (ou de la base)
Lorsque une solution tampon d'acide acétique (sodium) est préparée à partir d'un mélange 1:1 d'acide acétique et d'acétate de sodium, par exemple, le pH de la solution tampon est d'environ 4.7 (proche du pKa de l'acide acétique), et c'est à ce point que l'action tampon maximale peut être obtenue.
La capacité tampon augmente avec la concentration
La capacité tampon d'une solution tampon d'acide acétique (sodium) est plus grande à une concentration de 100 mM qu'à 10 mM, par exemple. Cependant, la précipitation se produit plus facilement à des concentrations plus élevées.
Attention à la solubilité des sels et à la précipitation
La solubilité des sels dépend du type de sel, comme le sel de potassium ou le sel de sodium. Les sels précipitent plus facilement lorsqu'un solvant organique est mélangé.
De plus, évitez d'utiliser des solutions tampons à base d'acides organiques (acides carboxyliques) autant que possible pour des analyses très sensibles à de courtes longueurs d'onde UV. Considérez les différentes conditions analytiques et utilisez une solution tampon appropriée, comme un acide organique avec un groupe hydroxyle en position α (voir Supplément) pour limiter les effets des ions d'impuretés métalliques. (J.Ma, Y.Eg)
|
Référence : |
1) LCtalk Vol. 29, 8 pKa et équilibre de dissociation, 2) LCtalk Vol. 26, 11, 3) LCtalk Vol. 40, 4 Préparation de la phase mobile. |
Méthodes de préparation des solutions tampons
| Solution tampon d'acide phosphorique (sodium) à 100 mM (pH=2.1) Dihydrogénophosphate de sodium dihydraté (M.W.=156.01)..50 mmol (7.8 g) Acide phosphorique (85 %, 14.7 mol/L).........................50 mmol (3.4 mL) Ajouter de l'eau pour compléter à 1 L. |
| Solution tampon d'acide phosphorique (sodium) à 10 mM (pH=2.6) Dihydrogénophosphate de sodium dihydraté (M.W.=156.01)..5 mmol (0.78 g) Acide phosphorique (85 %, 14.7 mol/L).........................5 mmol (0.34 mL) Ajouter de l'eau pour compléter à 1 L. (Alternativement, diluer une solution tampon d'acide phosphorique (sodium) à 100 mM (pH=2.1) dix fois.) |
| Solution tampon d'acide phosphorique (sodium) à 50 mM (pH=2.8) Dihydrogénophosphate de sodium dihydraté (M.W.=156.01)..40 mmol (6.24 g) Acide phosphorique (85 %, 14.7 mol/L).........................10 mmol (0.68 mL) Ajouter de l'eau pour compléter à 1 L. |
| Solution tampon d'acide phosphorique (sodium) à 100 mM (pH=6.8) Dihydrogénophosphate de sodium dihydraté (M.W.=156.01)..50 mmol (7.8 g) Dihydrogénophosphate de sodium 12-hydraté (M.W.=358.14)..50 mmol (17.9 g) Ajouter de l'eau pour compléter à 1 L. |
| Solution tampon d'acide phosphorique (sodium) à 10 mM (pH=6.9) Dihydrogénophosphate de sodium dihydraté (M.W.=156.01)..5 mmol (0.78 g) Dihydrogénophosphate de sodium 12-hydraté (M.W.=358.14)..5 mmol (1.79 g) Ajouter de l'eau pour compléter à 1 L. (Alternativement, diluer une solution tampon d'acide phosphorique (sodium) à 100 mM (pH=6.8) dix fois.) |
| Solution tampon d'acide citrique (sodium) à 20 mM (pH=3.1) Acide citrique monohydraté (M.W.=210.14)...............16.7 mmol (3.51 g) Citrate trisodique dihydraté (M.W.=294.10)..3.3 mmol (0.97 g) Ajouter de l'eau pour compléter à 1 L. |
| Solution tampon d'acide citrique (sodium) à 20 mM (pH=4.6) Acide citrique monohydraté (M.W.=210.14)...............10 mmol (2.1 g) Citrate trisodique dihydraté (M.W.=294.10)..10 mmol (2.94 g) Ajouter de l'eau pour compléter à 1 L. |
| Solution tampon d'acide tartrique (sodium) à 10 mM (pH=2.9) Acide tartrique (M.W.=150.09)..........................7.5 mmol (1.13 g) Tartrate de sodium dihydraté (M.W.=230.08)........2.5 mmol (0.58 g) Ajouter de l'eau pour compléter à 1 L. |
| Solution tampon d'acide tartrique (sodium) à 10 mM (pH=4.2) Acide tartrique (M.W.=150.09)..........................2.5 mmol (0.375 g) Tartrate de sodium dihydraté (M.W.=230.08)........7.5 mmol (1.726 g) Ajouter de l'eau pour compléter à 1 L. |
| Solution tampon éthanolamine (acide acétique) à 20 mM (pH=9.6) Monoéthanolamine (M.W.=61.87, d=1.017)...20 mmol (1.22 mL) Acide acétique (acide acétique glaciaire, 17.4 mol/L)..................10 mmol (0.575 mL) Ajouter de l'eau pour compléter à 1 L. |
| Solution tampon d'acide acétique (sodium) à 100 mM (pH=4.7) Acide acétique (acide acétique glaciaire) (99.5 %, 17.4 mol/L)..................50 mmol (2.87 mL) Acétate de sodium trihydraté (M.W.=136.08)........50 mmol (6.80 g) Ajouter de l'eau pour compléter à 1 L. |
| Solution tampon d'acide borique (potassium) à 100 mM (pH=9.1) Acide borique (M.W.=61.83)...............100 mmol (6.18 g) Hydroxyde de potassium (M.W.=56.11)...............50 mmol (2.81 g) Ajouter de l'eau pour compléter à 1 L. |
| Solution tampon d'acide borique (sodium) à 100 mM (pH=9.1) Acide borique (M.W.=61.83)...............100 mmol (6.18 g) Hydroxyde de sodium (M.W.=40.00)...............50 mmol (2.00 g) Ajouter de l'eau pour compléter à 1 L. |
Supplément
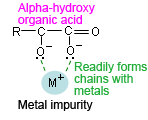
Un acide organique avec un groupe hydroxyle (acide citrique, acide tartrique, etc.) en position α a une structure en "pince de crabe" qui forme facilement des chaînes avec des impuretés métalliques dans la phase mobile.
Balance analytique Shimadzu Série AP
Réponse plus rapide et stabilité accrue
Les balances analytiques Shimadzu disposent d'un capteur de pesée UniBloc monobloc, qui est désormais encore plus avancé.
Mode de préparation de solution tampon
- Des recettes pour 13 solutions tampons couramment utilisées sont incluses en standard
Des recettes de préparation pour des solutions tampons couramment utilisées sont fournies en standard - Instructions affichées à l'écran
La valeur de pesée cible est affichée à l'écran et sur une barre analogique afin de comparer la cible avec le poids actuel. Aucun calcul manuel n'est nécessaire. - Fonction d'enregistrement
Enregistrement de la sortie avec date, heure et nom de l'opérateur.







