Méthode de la pastille KBr
- Échantillons qui ne peuvent pas être analysés par la méthode des pastilles de KBr (Hydrochlorures) -
Beaucoup de gens savent que depuis la Quatorzième Édition de la Pharmacopée Japonaise, la méthode de test générale est passée de la méthode des pastilles de bromure de potassium (KBr) à un choix entre la méthode des pastilles de KBr ou la méthode des pastilles de chlorure de potassium (KCl). Mais il n'est pas bien connu pourquoi la méthode de test prescrite a été modifiée ou quelle méthode de test doit être appliquée à quel échantillon. Cette Application News compare la méthode des pastilles de KBr et la méthode des pastilles de KCl sur les hydrochlorures, qui sont des échantillons typiques qui ne doivent pas être analysés en utilisant la méthode des pastilles de KBr.
■ Pelletiseur (presse manuelle miniature)
La Fig. 1 montre le pelletiseur MHP-1 utilisé pour préparer les échantillons de test. Les accessoires fournis rendent extrêmement facile la formation de pastilles de 4 mm de diamètre (auparavant 3 mm de diamètre). Contrairement aux pelletiseurs conventionnels, il ne nécessite pas de pompe à vide. C'est une presse manuelle qui peut former rapidement les pastilles.
Conformément à la Pharmacopée Japonaise, la gamme de nombres d'ondes a été fixée de 4000 à 400 cm-1 pour les mesures. Le Tableau 1 montre en détail les conditions de mesure.
Tableau 1 Conditions de Mesure
- Résolution : 4 cm-1
- Accumulation : 45
- Détecteur : DLATGS

Fig 1 Apparence du Pelletiseur MHP-1
■ Mesure de l'Hydrochlorure de L-Cystéine
La Fig. 2 montre le spectre mesuré par la méthode des pastilles de KCl (bleu) et le spectre mesuré par la méthode des pastilles de KBr (rouge). La Fig. 3 montre une image agrandie de la Fig. 2 dans la plage de 900 à 700 cm-1.
La Fig. 3 montre que le spectre de la méthode des pastilles de KBr présente un pic à 800 cm-1 où aucun pic ne devrait exister. De plus, la position du pic près de 775 cm-1 est légèrement décalée vers l'extrémité basse fréquence dans le spectre de la méthode des pastilles de KBr. La différence entre les deux spectres résulte d'un échange d'ions entre les ions chlorure et les ions bromure lorsqu'un échantillon d'hydrochlorure est dilué par KBr. Bien que non montré ici, l'accessoire ATR à réflexion unique peut obtenir un spectre équivalent à la méthode des pastilles de KCl, sans prétraitement.
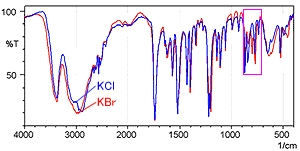
Fig. 2 Spectres de l'Hydrochlorure de L-Cystéine
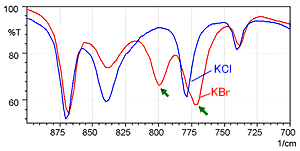
Fig. 3 Vue Agrandie de la Fig. 2
La Fig. 4 montre une série chronologique de spectres mesurés pour l'hydrochlorure de L-cystéine en utilisant la méthode des pastilles de KBr (avec la même gamme de nombres d'ondes que la Fig. 3). La ligne bleue est le spectre immédiatement après la formation de la pastille, la ligne rouge a été mesurée après 2 minutes, et la ligne verte a été mesurée après 10 minutes.
La Fig. 4 montre que l'intensité du pic près de 800 cm-1 augmente progressivement, tandis que le pic près de 840 cm-1 diminue. De plus, on peut voir que le pic près de 775 cm-1 se décale progressivement vers l'extrémité basse fréquence. Cela indique également un échange d'ions progressif lorsque l'hydrochlorure de L-cystéine est analysé en utilisant la méthode des pastilles de KBr.
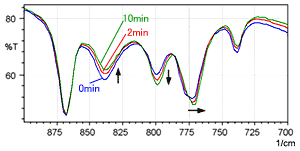
Fig. 4 Spectre de l'Hydrochlorure de L-Cystéine (Méthode des Pastilles de KBr)
■ Mesure de l'Hydrochlorure de Diphenhydramine
La Pharmacopée Japonaise prescrit la méthode des pastilles de KCl pour l'analyse de l'hydrochlorure de diphenhydramine, au lieu de la méthode des pastilles de KBr. Ici, nous comparons les différences entre l'analyse par ces deux méthodes.
La Fig. 5 montre les spectres de l'hydrochlorure de diphenhydramine mesurés en utilisant la méthode des pastilles de KBr et la méthode des pastilles de KCl. La ligne rouge est le spectre de la méthode des pastilles de KBr et la ligne bleue est le spectre de la méthode des pastilles de KCl.
Les formes des spectres sont clairement différentes près de 3000 cm-1. D'autres différences sont également apparentes dans la région basse fréquence. La Fig. 6 montre une image agrandie de la plage de longueurs d'onde de 1500 à 400 cm-1 où des différences sont apparentes.
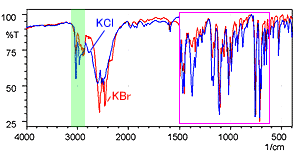
Fig. 5 Spectres de l'Hydrochlorure de Diphenhydramine
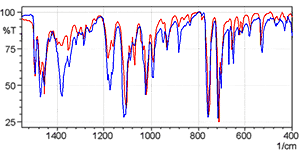
Fig. 6 Vue Agrandie de la Fig. 5
L'observation des données pour la mesure ATR à réflexion unique de l'hydrochlorure de diphenhydramine dans Application News A323 (pdf, 40 kB) indique clairement que le spectre de la méthode des pastilles de KBr est déformé en raison de l'échange d'ions. Cependant, la méthode des pastilles de KCl obtient un spectre similaire à la méthode ATR à réflexion unique. Si un échange d'ions se produit avec l'échantillon pendant les mesures des pastilles de KCl, comme les ions échangés sont les mêmes ions chlorure, cela ne change pas la structure de l'échantillon.
Comme indiqué ci-dessus, comme un échange d'ions se produit dans certains échantillons d'hydrochlorure lorsqu'ils sont analysés en utilisant la méthode des pastilles de KBr, les résultats de l'analyse par la méthode des pastilles de KBr doivent être confirmés par une autre méthode d'analyse.
- Échantillons nécessitant une prudence particulière avec la méthode des pastilles de KBr -
Points importants relatifs à la méthode des pastilles de KBr Partie 1 a introduit les hydrochlorures comme des échantillons typiques qui ne doivent pas être analysés en utilisant la méthode des pastilles de KBr en raison de l'échange d'ions. La Partie 2 introduit l'analyse de la L-arginine et de l'acide citrique, pour lesquels les spectres peuvent se déformer lorsqu'ils sont analysés en utilisant la méthode des pastilles de KBr.
■ Mesure de la L-Arginine
La Fig. 1 montre le spectre de la L-arginine mesuré par la méthode des pastilles de KBr. Le Tableau 1 montre les conditions de mesure.
Tableau 1 Conditions de Mesure
- Résolution : 4 cm-1
- Accumulation : 45
- Détecteur : DLATGS
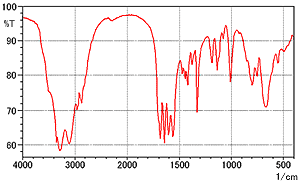
Fig. 1 Spectre de la L-Arginine (Méthode des Pastilles de KBr)
Les Fig. 2A et 2B montrent le spectre de la Fig. 1 superposé avec le spectre mesuré par la méthode ATR à réflexion unique (DuraSamplIR-II, prisme diamant/KRS-5), qui ne nécessite aucun prétraitement. Les données de la méthode ATR à réflexion unique sont corrigées pour l'ATR et les intensités sont ajustées pour une comparaison facile. La ligne rouge est le spectre de la méthode des pastilles de KBr et la ligne bleue est le spectre ATR à réflexion unique.
La Fig. 2B montre que le nombre de pics est clairement différent près de 1500 à 1750 cm-1. La Fig. 2A montre que les formes des pics sont également différentes dans d'autres régions. Les facteurs causant les différences de forme spectrale dues à la méthode de mesure sont supposés inclure l'humidité dans la poudre de KBr et la pression appliquée lors de la formation des pastilles. Ces facteurs sont examinés ci-dessous.
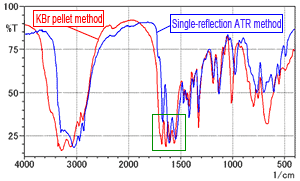
Fig. 2A Spectre de la L-Arginine (Comparaison de la méthode des pastilles de KBr et de la méthode ATR à réflexion unique)
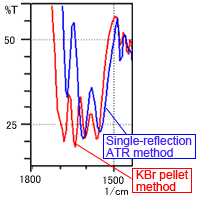
Fig. 2B Spectre de la L-Arginine (Image agrandie près de 1500 à 1800 cm-1)
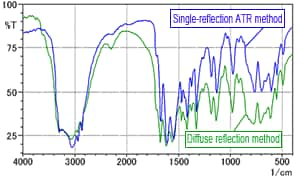
Fig. 3 Spectre de la L-Arginine (Comparaison de la méthode de réflexion diffuse et de la méthode ATR à réflexion unique)
(1) En supposant des effets de l'humidité dans la poudre de KBr uniquement
Pour examiner les effets de l'humidité contenue dans la poudre de KBr, sans influence du processus de pressage, la L-arginine a été mesurée en utilisant la méthode de réflexion diffuse. La méthode de réflexion diffuse implique également un mélange avec de la poudre de KBr, mais permet d'examiner les effets de l'humidité seule, sans former la poudre en pastilles. La Fig. 3 montre le spectre de réflexion diffuse obtenu superposé au spectre ATR à réflexion unique. La ligne verte est le spectre de réflexion diffuse et la ligne bleue est le spectre ATR à réflexion unique. La Fig. 3 montre des différences mineures d'intensité des pics mais aucune différence majeure entre les spectres. Par conséquent, il est difficile de conclure que l'humidité dans la poudre de KBr a un quelconque effet.
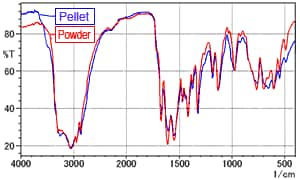
Fig. 4 Spectre ATR de la L-Arginine (Comparaison de la poudre et de la pastille)
(2) En supposant des effets de la pression de pelletisation uniquement
Pour examiner les effets de la pression appliquée lors de la pelletisation, la L-arginine a été directement formée en pastilles (sans processus de mélange avec de la poudre de KBr) et mesurée en utilisant la méthode ATR à réflexion unique. La Fig. 4 montre le spectre de la poudre (ligne rouge) superposé au spectre de la pastille (ligne bleue).
La Fig. 4 ne montre pas de différences significatives entre les spectres. Par conséquent, il est difficile de conclure que la pression de pelletisation a un quelconque effet.
D'après les résultats ci-dessus, il est supposé que les effets lors de la mesure de la L-arginine par la méthode des pastilles de KBr ne sont pas dus à l'humidité dans la poudre de KBr ou à la pression de pelletisation seule, mais plutôt à une combinaison des deux. Par conséquent, pour vérifier les effets de l'humidité dans les pastilles sur le spectre, nous avons analysé une pastille tout en la séchant dans un séchoir.
La Fig. 5 montre les changements dans le spectre pendant le séchage de la pastille.
La ligne rouge est le spectre immédiatement après la formation de la pastille. Les lignes bleue, verte et noire sont les spectres mesurés après 1, 3 et 10 minutes de séchage, respectivement. L'encart est une image agrandie de 1500 à 1800 cm-1.
La Fig. 5 montre une absorption réduite par le groupe O-H près de 3500 cm-1 et une diminution du nombre de pics de quatre à trois près de 1500 à 1750 cm-1. Le spectre après 10 minutes de séchage ressemble étroitement au spectre mesuré en utilisant la méthode ATR à réflexion unique.
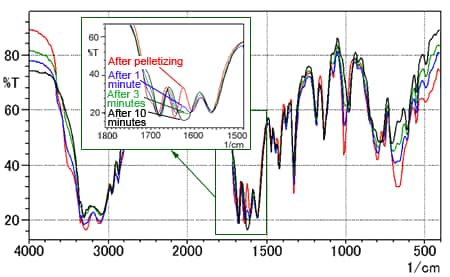
Fig. 5 Série chronologique des spectres de la L-Arginine (Méthode des pastilles de KBr)
Ces résultats indiquent que l'humidité contenue dans la poudre de KBr lors de la production de la pastille affecte la forme spectrale lorsque la L-arginine est mesurée par la méthode des pastilles de KBr.
■ Mesure de l'Acide Citrique
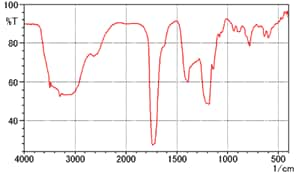
Fig. 6 Spectre de l'Acide Citrique (Méthode des pastilles de KBr)
La Fig. 6 montre le spectre de l'acide citrique mesuré en utilisant la méthode des pastilles de KBr. Les formes des pics diffèrent du spectre de l'acide citrique listé dans le Supplément 1 de la Quatorzième Édition de la Pharmacopée Japonaise, qui n'est pas montré ici. (Il y a plus de pics en général et le pic près de 1700 cm-1 est divisé dans le spectre de la Pharmacopée Japonaise.) 1)
La Fig. 7 montre les spectres mesurés pour une pastille après l'avoir séchée dans un séchoir. La ligne rouge est le spectre immédiatement après la formation de la pastille. Les lignes bleue et verte sont les spectres mesurés après 3 et 10 minutes de séchage, respectivement.
La Fig. 7 indique un changement dans la forme du pic près de 1700 cm-1 après séchage. Après 10 minutes de séchage, la forme du spectre est devenue la même que celle du spectre listé dans la Pharmacopée Japonaise. (Cependant, le temps réel dépend de la puissance du séchoir.) Par conséquent, faites attention au contenu en humidité de la poudre de KBr lors de l'analyse de l'acide citrique en utilisant la méthode des pastilles de KBr.
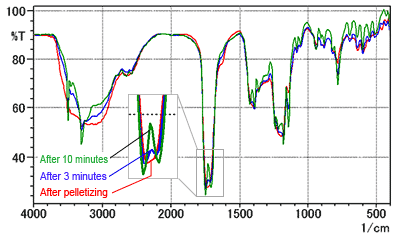
Fig. 7 Série chronologique des spectres de l'Acide Citrique (Méthode des pastilles de KBr)






