Vue d'ensemble de la LC-MS
La chromatographie liquide (LC) est une technique de séparation, démontrée pour la première fois au début des années 1900 par le botaniste russe, Mikhail Semyonovich Tswett. La LC sépare les composants d'un échantillon en fonction des différences de leur affinité ou de leur force de rétention pour la phase stationnaire et la phase mobile. Cette séparation est illustrée dans la Figure 1 où les composants de l'échantillon sont séparés dans une colonne LC.
Il existe différentes techniques de LC disponibles et les principes de rétention et de séparation de chacune des techniques de LC diffèrent. Le Tableau 1 présente une liste des techniques de LC courantes et leur mécanisme de séparation. Avec les avancées actuelles en LC, elle a évolué vers des technologies de tailles de particules plus petites et de pressions plus élevées qui sont plus efficaces et de vitesse, sensibilité et résolution plus élevées, telles que la chromatographie liquide haute performance (HPLC) et la chromatographie liquide ultra haute performance (UHPLC).
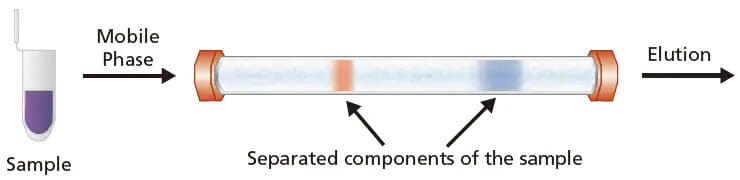
Figure 1. Une illustration du fonctionnement de la LC. L'échantillon (en violet) est injecté dans la colonne LC et se sépare en 2 bandes d'analytes (rouge et bleu) et est élué de la colonne.
| Type de techniques LC | Mécanisme de séparation | Utilisé couramment pour |
|---|---|---|
| LC en phase inverse (RPLC) | Une phase stationnaire non polaire et une phase mobile polaire sont utilisées pour la RPLC. Basée sur le principe "le semblable attire le semblable", l'échantillon est séparé en fonction de la préférence de polarité de la molécule pour la phase mobile polaire ou la phase stationnaire non polaire. Par exemple, les molécules non polaires préféreront se retenir dans la phase stationnaire non polaire plutôt que dans la phase mobile polaire. En conséquence, elles sont éluées plus tard par rapport aux molécules polaires. | Composés de faible poids moléculaire (PM) |
| LC en phase normale (NPLC) | La NPLC fonctionne de manière totalement opposée à la RPLC. Dans la NPLC, une phase stationnaire polaire et une phase mobile non polaire sont utilisées. Les molécules polaires sont fortement retenues par la phase stationnaire par rapport aux molécules non polaires. En conséquence, les molécules non polaires sont éluées en premier. | Hormones stéroïdes, phospholipides, saccharides et tocophérols |
| Chromatographie liquide à interaction hydrophile (HILIC) | La HILIC fonctionne selon le même principe que la NPLC. La principale différence est que de l'eau est ajoutée dans la phase mobile organique pour séparer et éluer efficacement les molécules polaires fortement retenues. | Composés polaires |
| Chromatographie par échange d'ions (IEC) | L'IEC retient et sépare les espèces chargées (ions) en fonction de l'affinité électrostatique de l'analyte pour la phase stationnaire contenant un groupe fonctionnel de charge opposée. L'élution différentielle est induite soit en modifiant le pH de la phase mobile pour neutraliser l'analyte, soit en augmentant la force ionique (concentration en sel) pour déplacer l'analyte de manière compétitive. | Protéines, acides aminés, nucléotides et ions inorganiques |
| Chromatographie d'exclusion de taille (SEC) | La colonne SEC utilisée est remplie de particules poreuses. Lorsque l'échantillon de différentes tailles s'écoule dans la colonne, les petites molécules migrent plus lentement car elles pénètrent profondément dans les pores, tandis que les grandes molécules s'écoulent rapidement car elles n'entrent pas autant dans les pores. En conséquence, les grandes molécules sont éluées de la colonne plus tôt, ce qui trie efficacement les échantillons par taille moléculaire. | Protéines et polymères synthétiques |
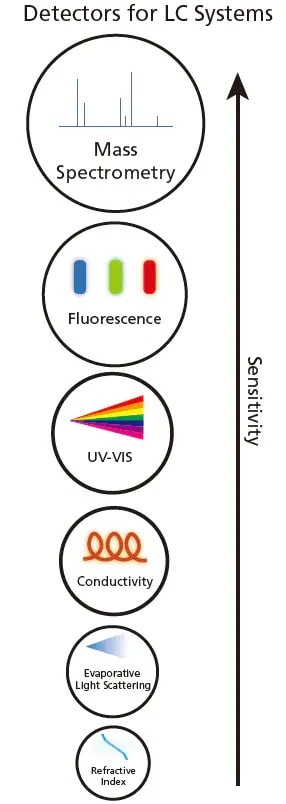
Figure 2. Divers détecteurs pour les systèmes LC par ordre croissant de sensibilité.
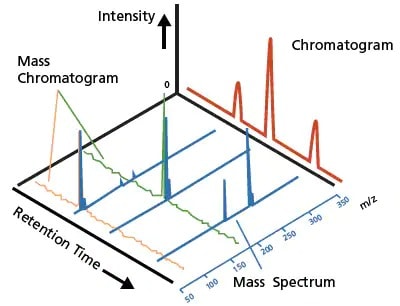
Figure 3. Un chromatogramme LC typique (rouge) et un chromatogramme de masse LCMS et un spectre de masse (bleu).
Après séparation par LC, les composants peuvent être détectés en utilisant des propriétés optiques telles que l'ultraviolet-visible (UV-VIS), la fluorescence, l'indice de réfraction, la diffusion de lumière évaporative ou la conductivité électrique en fonction des propriétés des analytes. La Figure 2 montre les différents détecteurs pour LC. Lorsque l'analyte passe à travers le détecteur, un changement (par exemple, une augmentation ou une diminution) de la propriété optique sera observé et enregistré.
Les chromatogrammes obtenus à l'aide de ces détecteurs optiques identifient ou qualifient principalement les substances en fonction du temps de rétention et quantifient les substances en fonction de la surface et de l'intensité du pic. Le chromatogramme LC (Figure 3, en rouge) montre un exemple de chromatogramme typique obtenu à l'aide de ces détecteurs optiques. La LC couplée à la détection optique offre une grande précision quantitative pour les analytes qui peuvent être résolus chromatographiquement, où un pic détecté ne comprend qu'un seul composant. Cependant, atteindre la résolution requise est difficile pour les échantillons complexes où plusieurs composants sont élués à peu près en même temps.
En revanche, la spectrométrie de masse (MS) offre une technique de détection hautement sensible qui ionise les composants de l'échantillon, sépare les ions résultants sous vide en fonction de leur rapport masse/charge (m/z) et mesure l'intensité de chaque ion. Un spectre de masse trace les intensités relatives des ions en fonction des valeurs de m/z, et une série de spectres de masse est générée à chaque point de temps (Figure 3, en bleu). Cette information indique le niveau de concentration des ions ayant une masse donnée et est extrêmement précieuse pour l'identification unique des molécules, également connue sous le nom d'analyse qualitative. De plus, la MS offre une spécificité et une sensibilité accrues, ainsi que la commodité de l'analyse simultanée de plusieurs composants.
Avec le couplage de la LC avec la MS, les spectres de masse obtenus à partir de ces mesures fournissent des informations sur la masse moléculaire et la structure des composants élués, qui complètent les informations qualitatives basées sur les temps de rétention obtenus à l'aide d'autres détecteurs LC. Par conséquent, la LCMS combine la résolution de séparation exceptionnelle de la LC avec les excellentes capacités qualitatives de la MS.







