Résultats de l'analyse LC-MS
Partie 3
Le développement de la méthode d'ionisation à pression atmosphérique (API) a permis d'ioniser une large gamme de composés organiques, ce qui a élargi le champ des applications de l'analyse LC-MS. D'ailleurs, quel type de spectres de masse est obtenu en utilisant l'API ? C'est le sujet de cette page.
Spectres de masse obtenus par API
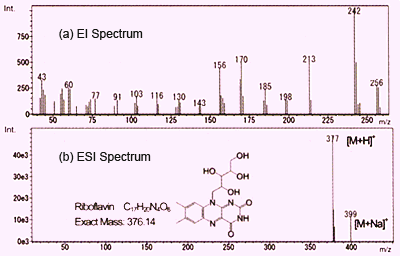
Fig. 1 Spectres de masse de la vitamine B2
Comme décrit précédemment, l'ESI et l'APCI aboutissent à la détection principalement de molécules protonées et également d'ions adducts de métal ou de solvant. Sur cette page, nous comparons ces méthodes avec l'ionisation par impact électronique (EI) couramment utilisée en GC-MS. La Figure 1 montre les spectres de la vitamine B2 (riboflavine) obtenus en utilisant l'EI et l'ESI. Ceux-ci sont représentés avec l'intensité des ions sur l'axe vertical et le rapport masse/charge (m/z) sur l'axe horizontal.
L'EI utilise un faisceau d'électrons pour libérer un électron des molécules en phase gazeuse afin de créer des ions moléculaires (cations radicaux). Ceux-ci éclatent instantanément pour générer un groupe d'ions fragments. Des informations structurelles peuvent être obtenues en considérant le schéma de ces ions fragments. Cependant, dans de nombreux cas, aucun pic d'ion moléculaire n'est détecté. Dans le cas de la Figure 1a, aucun ion moléculaire n'est détecté, mais plutôt, seuls des ions fragments sont détectés. Obtenir des informations sur la masse moléculaire est difficile en utilisant l'EI, ce qui nécessite l'utilisation d'une méthode analytique complémentaire telle que l'ionisation chimique (CI).
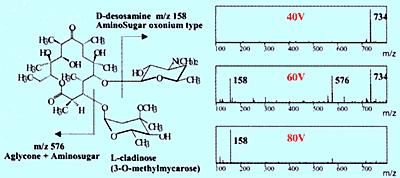
Fig. 2 Spectres de dissociation induite par collision de l'érythromycine
En revanche, l'utilisation de l'ESI, qui est une méthode d'ionisation douce, fournit un spectre simple avec une molécule protonée détectée à m/z 377 et un ion adduit de sodium détecté à m/z 399, et presque aucun ion fragment. De cette manière, des informations sur la masse moléculaire, qui sont importantes pour prédire la structure des composés inconnus, peuvent être facilement obtenues en utilisant l'API. (Dans cet exemple, puisque la vitamine B2 a un groupe fonctionnel basique, le mode ion positif est utilisé.) Cependant, en raison de la tendance de l'API à ne pas produire d'ions fragments, il semble difficile d'obtenir des informations structurelles sur les groupes fonctionnels et autres en analysant les ions fragments.
Néanmoins, des informations structurelles peuvent être obtenues en utilisant l'API si une méthode appelée dissociation induite par collision (CID) est utilisée pour créer des ions fragments, puis mesurer ces ions fragments. La CID peut se produire au niveau de la zone de la lentille électrostatique (Figure 2) ou en utilisant un spectromètre de masse de type tandem équipé d'une chambre de collision, qui est décrite ci-dessous. La Figure 2 montre un exemple de génération d'ions fragments à partir d'un antibiotique érythromycine en augmentant la tension appliquée à la lentille électrostatique. Ces ions peuvent être utilisés pour identifier les composants mineurs qui apparaissent dans le chromatogramme (voir Shimadzu Application News, LCMS No. C21).
Mesure des ions multivalents
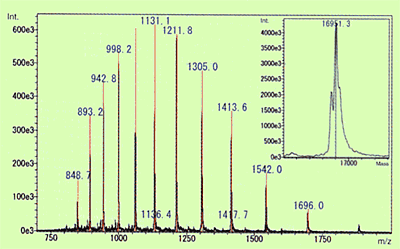
Fig. 3 Masse moléculaire de la myoglobine dans le muscle cardiaque équin calculée à l'aide du spectre ESI et de la déconvolution
Parmi les méthodes API, l'utilisation de l'ESI en particulier est connue pour parfois générer des ions moléculaires avec des charges multiples pour les composés ayant plusieurs points d'ionisation potentiels. (Dans le cas des cations, cela signifie que plusieurs protons sont ajoutés [M+nH]n+.) Le niveau de protonation est fortement influencé par le niveau de pKa du composé ou le niveau de pH de la solution. Lorsque ce type d'ion multivalent est observé, des informations sur la masse moléculaire peuvent être obtenues même pour des composés ayant une masse moléculaire qui dépasse la plage de mesure du spectromètre de masse. Par conséquent, cela est utilisé pour mesurer des macromolécules biologiques extrêmement grandes et très polaires, telles que les protéines et les acides nucléiques. La Figure 3 montre un spectre ESI de la myoglobine équine comme exemple de protéine. Dans ce cas, des ions avec des valences de 9 à 20 ont été détectés et la masse moléculaire a été calculée par déconvolution pour être de 16951,3. Comparée à la masse moléculaire théorique, 16951,5, calculée à partir de la composition des acides aminés, l'erreur était inférieure à 0,002 %, ce qui indique qu'une valeur extrêmement précise a été obtenue.
C'est une grande différence par rapport à la GC-MS, qui ne fournit généralement que des pics pour z=1.






